
Cer
| Sicherheitshinweise | |||||||
|---|---|---|---|---|---|---|---|
| |||||||
Cer (auch Zer bzw. Cerium genannt) ist ein chemisches Element mit dem Elementsymbol Ce und der Ordnungszahl 58. Im Periodensystem steht es in der Gruppe der Lanthanoide und zählt damit auch zu den Metallen der seltenen Erden.
Geschichte

Cer wurde 1803 von Jöns Jakob Berzelius und Wilhelm von Hisinger und gleichzeitig von Martin Heinrich Klaproth entdeckt. Es wurde nach dem Zwergplaneten Ceres benannt. Die Darstellung des Elements gelang Carl Gustav Mosander 1825 durch Reduktion des Chlorids mit Natrium.
Vorkommen
In der Natur kommt Cer vergesellschaftet mit anderen Lanthanoidenin sogenannten Ceriterden vor, wie zum Beispiel im Allanit (Ca, Ce, La, Y)2(Al, Fe)3(SiO4)3(OH), im Monazit (Ce, La, Th, Nd, Y)PO4 sowie im Bastnäsit (Ce, La, Y)CO3F. Cer ist das häufigste Element der Lanthanoide und steht in der Elementhäufigkeit auf Platz 28. In der Erdkruste, bis in eine Tiefe von 16 km gerechnet, ist es mit 68 g/t vertreten und kommt damit häufiger als Zinn oder Blei vor. Wichtige Lagerstätten befinden sich in Skandinavien, USA, Kongo, Südafrika und Indien. Die weltweit bekannten Cer-Reserven werden auf 40 Mio. Tonnen geschätzt. Cer gehört zu den sogenannten leichten Seltenen Erden, die 2014 von der Bundesanstalt für Geowissenschaften und Rohstoffe (BGR) als unkritisch bezüglich der Versorgungslage eingeschätzt wurden.
Gewinnung und Herstellung
Nach einer aufwendigen Abtrennung der Cer-Begleiter wird das Oxid mit Fluorwasserstoffzum Cerfluorid umgesetzt. Anschließend wird es mit Calcium unter Bildung von Calciumfluorid zum Cer reduziert. Die Abtrennung verbleibender Calciumreste und Verunreinigungen erfolgt in einer zusätzlichen Umschmelzung im Vakuum. Die jährliche Weltproduktion liegt bei ca. 24.000 t.
Eigenschaften
Physikalische Eigenschaften
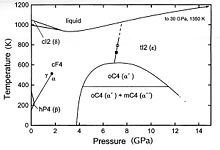
Von Cer sind vier Modifikationen bekannt:
Das silbrigweiß glänzende Metall ist hinter Europium das zweitreaktivste Element der Lanthanoide. Oberflächliche Verletzungen der schützenden gelben Oxidschicht entzünden das Metall. Oberhalb von 150 °C verbrennt es unter heftigem Glühen zum Cerdioxid. Mit Wasser reagiert es zum Cerhydroxid.
Chemische Eigenschaften
Cer kommt in Verbindungen als dreiwertiges farbloses oder vierwertiges gelbes bis orangefarbiges Kation vor.
Unter Wärmeeinfluss wird es durch Ethanol und Wasser sehr stark angegriffen. Auch in Laugen wird es unter Bildung von Cer-Hydroxiden stark angegriffen. In Säurenwird es zu Salzen gelöst.
| Eigenschaften | |
|---|---|
| Allgemein | |
| Name, Symbol, Ordnungszahl | Cer, Ce, 58 |
| Serie | Lanthanoide |
| Gruppe, Periode, Block | La, 6, f |
| Aussehen | silbrig weiß |
| CAS-Nummer | |
| EG-Nummer | 231-154-9 |
| ECHA-InfoCard | |
| Massenanteil an der Erdhülle | 43 ppm |
| Physikalisch | |
| Aggregatzustand | fest |
| Kristallstruktur | kubisch flächenzentriert |
| Dichte | 6,773 g/cm3 (25 °C) |
| Mohshärte | 2,5 |
| Magnetismus | paramagnetisch
(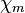 = 1,4 · 10−3)
= 1,4 · 10−3) |
| Schmelzpunkt | 1068 K (795 °C) |
| Siedepunkt | 3743 K (3470 °C) |
| Molares Volumen | 20,69 · 10−6 m3/mol |
| Verdampfungswärme | 398 kJ/mol |
| Schmelzwärme | 5,5 kJ/mol |
| Schallgeschwindigkeit | 2100 m/s bei 293,15 K |
| Elektrische Leitfähigkeit | 1,35 · 106 A/(V · m) |
| Wärmeleitfähigkeit | 11 W/(m · K) |
| Chemisch | |
| Oxidationszustände | 3, 4 |
| Normalpotential | −2,34 V (Ce3+ + 3 e− → Ce) |
| Elektronegativität | 1,12 (Pauling-Skala) |
Verwendung
Da sich die chemischen Eigenschaften der Seltenen Erdenähneln, wird metallisches Cer selten in Reinform eingesetzt, sondern in der Mischung, in der es bei der Herstellung aus den Seltenerd-Mineralien anfällt, dem sogenannten Mischmetall.
- In der Metallurgie dient Mischmetall als Zusatz für Aluminiumlegierungen und hochtemperaturbeständige Eisenbasislegierungen. Es unterstützt im Schmelzprozess die Abtrennung von Schwefel und Sauerstoff.
- Die Eisen-Mischmetall-Legierung Cereisen dient als Ausgangsstoff für Zündsteine für die Verwendung in Feuerzeugen und zur Erzeugung von Funkenregen auf Achterbahnen und in Filmszenen (Unfallszenen).
Geringe Beimengungen von (mehr oder weniger reinen) Cer-Verbindungen verleihen anderen Materialien bestimmte Eigenschaften:
- Cerdioxid (CeO2) wird zur Stabilisierung des keramischen Katalysatorträgers aus Aluminiumoxidfür Autoabgaskatalysatoren verwendet
- Bestandteil einiger Spezialgläser, zum Beispiel UV-Filter und Windschutzscheiben, und Enttrübungsmittel in der Glasherstellung
- Zur Färbung von Emaille
- Cerdioxid findet Verwendung als Poliermittel in der Glasbearbeitung
- Cer-dotierte Fluoreszenz-Farbstoffe (Leuchtstoffe) in Bildröhren und weißen Leuchtdioden
- als Dotierung in Glühstrümpfen
- Selbstreinigende Backöfen enthalten eine cerhaltige Beschichtung
- Cer(IV)-sulfat als Oxidationsmittel in der Quantitativen Analyse (Cerimetrie)
- als Kontrastmittel bei Kernresonanz
- als Leuchtstoff in Gasentladungsröhren
- zur Regeneration von Rußpartikelfiltern im Kraftstoff gelöst beigemischt
- als Teil von nichtedelmetallhaltigen Aufbrennlegierungen in der Zahntechnik (Keramik)
- als Oxidationsmittel für organische Synthesen mit CAN (Cerium ammonium nitrat), (NH4)2Ce(NO3)6
Biologische Bedeutung
2013 wurde erstmals ein Enzym in Bakterien entdeckt, das Cer-Ionen für seine Funktion benötigt. Die Bakterien der Art Methylacidiphilum fumariolicum wurden aus italienischer Lava isoliert. Sie benötigen Cer zum Aufbau der Methanol-Dehydrogenase, einem Enzym im Methan-Stoffwechsel. Das Ion hat dabei die Rolle, die in ähnlichen Enzymen in anderen Bakterien von Calciumionen übernommen wird.
Sicherheitshinweise
Cer ist, wie alle Lanthanoide, leicht giftig. Metallisches Cer kann sich schon ab 65 °C entzünden. Als fein verteiltes Metall kann es sich an der Luft ohne Energiezufuhr erhitzen und schließlich entzünden. Die Zündbereitschaft hängt u.a. sehr stark von der Korngröße und dem Verteilungsgrad ab. Cerbrände dürfen nicht mit Wasser gelöscht werden, da sich gasförmiger Wasserstoffentwickelt.
Verbindungen
Oxide- Cer(III)-oxid Ce2O3, goldglänzender keramischer Feststoff
- Cer(IV)-oxid CeO2
- Cer(III,IV)-oxid Ce3O4, blauer keramischer Feststoff


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 05.01. 2024
