
Isopeptidbindung
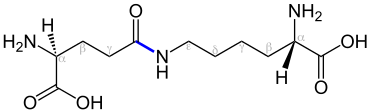
Als Isopeptidbindungen werden in der Biochemie die Sonderform einer Amidbindung zwischen zwei Aminosäuren bezeichnet, bei der zumindest eine der beteiligten funktionellen Gruppen nicht am α-C-Atom der Aminosäure sitzt [3].
Ein Beispiel dafür wäre eine Amidbindung zwischen der seitenständigen ε-Aminogruppe von L-Lysin und der seitenständigen Carboxygruppe von L-Asparaginsäure oder L-Glutaminsäure. Die Verknüpfung der Aminosäuren erfolgt also nicht (ausschließlich) über α-ständige Amino- und Carboxygruppen.[1] Isopeptidbindungen werden beispielsweise bei der kovalenten Verknüpfung von Fibrin im Rahmen der Blutgerinnung durch den Faktor XIII zwischen Lysin und Glutamin geschlossen.
α-Peptidbindungen und ω-Peptidbindungen sind Isopeptidbindungen

Bei einer α-Aminosäure, die neben der α-Aminogruppe eine zweite Aminogruppe in ω-Position enthält, z.B. L-Lysin, und einer weiteren α-Aminosäure die über die α-Carboxygruppe mit der endständigen Aminogruppe der ersten Aminosäure verknüpft ist, entsteht eine ω-Peptidbindung. Ebenso gibt es α-Aminosäuren, die neben der α-Carboxygruppe eine zweite Carboxygruppe enthalten, z.B. L-Asparaginsäure und L-Glutaminsäure. Wenn in diesem Fall über die endständige zweite Carboxygruppe und die α-Aminogruppe einer weiteren α-Aminosäure eine Amidbindung gebildet wird, so entsteht ebenfalls eine ω-Peptidbindung.[1] In der Natur kommen auch Mischformen vor, so enthält das Tripeptid Glutathion (γ-L-Glutamyl-L-cysteinglycin)[2] je eine α-Peptidbindung und eine ω-Peptidbindung.
Auch ω-Peptidbindungen und α-Peptidbindungen zählen zu den Isopetidbindungen.[3]
Einzelnachweise
- ↑ Hochspringen nach: a b Hans-Dieter Jakubke, Hans Jeschkeit: Aminosäuren, Peptide, Proteine, Verlag Chemie, Weinheim, S. 99, 1982, ISBN 3-527-25892-2.
- ↑ Otto-Albrecht Neumüller (Hrsg.): Römpps Chemie-Lexikon. Band 2: Cm–G. 8. neubearbeitete und erweiterte Auflage. Franckh’sche Verlagshandlung, Stuttgart 1981, ISBN 3-440-04512-9, S. 1511.
- ↑ Hae Joo Kang, Edward N. Baker: Intramolecular isopeptide bonds: protein crosslinks built for stress? In: Trends in Biochemical Sciences. Band 36, Nummer 4, 2011, S. 229-237, doi:10.1016/j.tibs.2010.09.007.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 14.05. 2024