Ionisierungsenergie
Die Ionisierungsenergie (auch Ionisationsenergie, Ionisierungspotential, Ionisierungsenthalpie) ist die Energie, die benötigt wird, um ein in der Gasphase befindliches Atom oder Molekül zu ionisieren, d.h., um ein Elektron vom Atom oder Molekül zu trennen. Sie kann durch Strahlung, eine hohe Temperatur des Materials oder chemisch geliefert werden.
Allgemeines
Nach der Ionisierung hat ein vorher elektrisch neutrales Atom oder Molekül eine positive elektrische Ladung. Die vorher ausgeglichene Ladungsdifferenz zwischen Atomkern(en) und Elektronenhülle ist durch das Entfernen eines Elektrons verschoben. Man spricht von einem positiv ionisierten Atom bzw. Molekül oder einem Kation. Dieses kennzeichnet man durch ein nachfolgend hochgestelltes '+'-Zeichen; z.B. wird ein Natriumkation als Na+ gekennzeichnet (Na ist das Elementsymbol für Natrium).
Solange ein Kation noch Elektronen besitzt, kann es durch weitere Energiezufuhr weiter ionisiert werden, allerdings nimmt die erforderliche Energie mit jeder zusätzlichen Ionisierung zu. Allgemein ist die n-te Ionisierungsenergie die Energie, die benötigt wird, um das n-te Elektron zu entfernen. Symbolisch wird ein mehrfach ionisiertes Kation durch eine vor das '+'-Zeichen gestellte Zahl identifiziert; z.B. wird ein 3-fach ionisiertes Aluminiumkation als Al3+ bezeichnet.
Einheit
Für ein einzelnes Elektron wird die Ionisierungsenergie in eV/Atom angegeben, für
1 Mol
Stoffmenge aber in kJ/mol. Der Umrechnungsfaktor
ergibt sich aus der Umrechnung zwischen eV und kJ sowie der Avogadro-Konstante
zu:
- 1 eV = 96,485307 kJ/mol
wobei auf der linken Seite das "pro Atom" wie hier meist weggelassen wird.
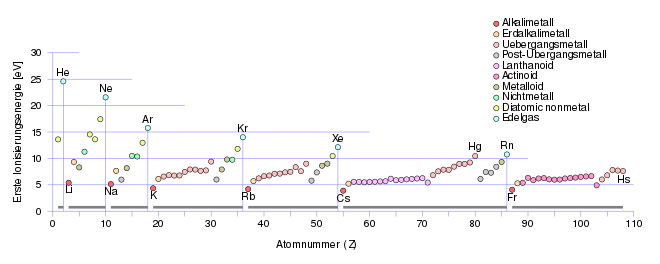
Erste Ionisierungsenergie und Periodensystem
Die erste Ionisierungsenergie hängt von der Anziehungskraft zwischen dem Atomkern und dem zu entfernenden Elektron ab, welche sich nach der Coulomb-Formel berechnet:
mit
- Ordnungs- bzw.
Kernladungszahl
- Elementarladung
- Abstand
des Elektrons vom Kern
- Coulomb-Konstante
Innerhalb einer Periode
steigt die erste Ionisierungsenergie stark an, wenn auch die Zunahme von links
nach rechts unstetig verläuft. Grund für die Zunahme ist die steigende
Kernladungszahl
und die dadurch bedingte stärkere Anziehung der Elektronen durch den Kern. Zwar
nimmt auch die Elektronenzahl der Hülle innerhalb der Periode von links nach
rechts in gleichem Maß zu, das jeweils hinzukommende Elektron wird jedoch immer
in dieselbe Schale eingebaut, die Außenschale. Die dort schon vorhandenen
Elektronen können das jeweils hinzukommende Elektron deshalb nicht so stark von
der Kernladung abschirmen, weil sie denselben Kernabstand besitzen wie das
hinzugekommene Elektron. Die Zunahme der Kernladung kann also nicht durch die
Zunahme der Ladung der Elektronenhülle kompensiert werden, so dass die
Ionisierungsenergie zunimmt. Der unstetige Charakter der Zunahme zeigt sich
besonders stark beim Übergang vom Stickstoff
zum Sauerstoff. Hier nimmt die
Ionisierungsenergie von links nach rechts sogar ab. Die Gründe für solche
Unstetigkeiten lassen sich mit dem Atomorbitalmodell
deuten. So besitzt Stickstoff mit seiner halb besetzten p-Unterschale eine
energiearme, stabile Elektronenkonfiguration. Für die Entfernung eines Elektrons
wird deshalb besonders viel Energie benötigt. Insgesamt stellen die
Ionisierungsenergien der Alkalimetalle
jeweils das Minimum und die Ionisierungsenergien der Edelgase
jeweils das Maximum der Periode dar. Diese Extrema werden innerhalb einer Gruppe
von oben nach unten geringer, da sich das zu entfernende Elektron nach dem
Schalenmodell
des Atoms auf einer neuen Schale befindet, somit sein Abstand
vom Kern ansteigt und weniger Energie aufgewendet werden muss, um es aus der
Anziehungskraft des Kerns zu lösen. Entsprechend nimmt die erste
Ionisierungsenergie beim Übergang von einer Periode zur nächsten, z.B. vom
Neon zum Natrium, schlagartig ab.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 09.03. 2025