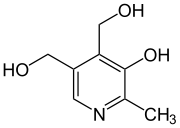
Pyridoxin
| Sicherheitshinweise | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||
Pyridoxin (veraltet auch Adermin) ist eine feste, wasserlösliche chemische Verbindung, die als lebensnotwendige Verbindung zu den Vitaminen zählt.
Zusammen mit ihren Derivaten Pyridoxal (mit Aldehydfunktion) und Pyridoxamin (mit Aminogruppe), die in vivo(in der lebenden Zelle) leicht ineinander umgewandelt werden, bilden sie die Gruppe Vitamin B6. Die aktive Form der Vitamin-B6-Gruppe heißt Pyridoxalphosphat.
Geschichte
Die physiologische Bedeutung von Pyridoxin wurde durch diätische Fütterversuche an Ratten 1934 durch Paul György entdeckt und die Verbindung erstmals 1938 kristallin dargestellt. Die vollständige Aufklärung seiner Konformation gelang bereits ein Jahr später. Der Mechanismus der Wirkung wurde insbesondere von Alexander E. Braunstein in den 1950er Jahren geklärt. Heute wird Pyridoxin zu der Gruppe der B-Vitamine als Vitamin B6 gezählt und findet, wie auch sein Hydrochlorid, als Arzneistoff Anwendung.
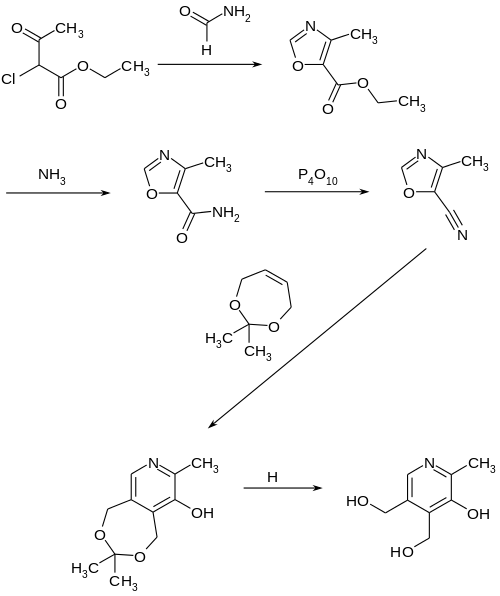
Synthese
Synthese nach Roche / DSM
Als Ausgangspunkt dient hier 2-Chloracetessigsäureethylester, der mit Formamid zum 4-Methyloxazol-5-carbonsäureester kondensiert wird. Im nächsten Schritt wird aus diesem mit Ammoniak das Amid gebildet und anschließend mit Phosphorpentoxid in das Nitril überführt. Das so entstandene 4-Methyloxazol-5-carbonitril reagiert in einer Diels-Alder-Reaktion mit dem cyclischen Ketal von 2-Buten-1,4-diol bei 180 °C zum Primäraddukt, das unter Cyanwasserstoffabspaltung das cyclische Ketal von Pyridoxin mit Aceton ergibt. Eine saure Spaltung liefert schließlich Pyridoxin.
| Strukturformel | |
|---|---|
 | |
| Allgemeines | |
| Trivialname | Pyridoxin |
| Andere Namen |
|
| Summenformel | C8H11NO3 |
| CAS-Nummer |
|
| ATC-Code | A11HA02 |
| Kurzbeschreibung | farbloser Feststoff |
| Vorkommen | Weizenkeime, Lachs, Walnuss |
| Physiologie | |
| Funktion | Coenzym bei verschiedenen enzymatischen Reaktionen, vor allem im Aminosäurestoffwechsel |
| Täglicher Bedarf | 1,6–1,8 mg |
| Folgen bei Mangel | Durchfall und Erbrechen, Dermatitis, Krampfzustände, neurologische Störungen |
| Überdosis | > 500 mg/d |
| Eigenschaften | |
| Molare Masse | 169,18 g/mol |
| Aggregatzustand | fest |
| Schmelzpunkt | 159−162 °C |
| Löslichkeit | löslich in Wasser (120 g/l (20 °C)) |
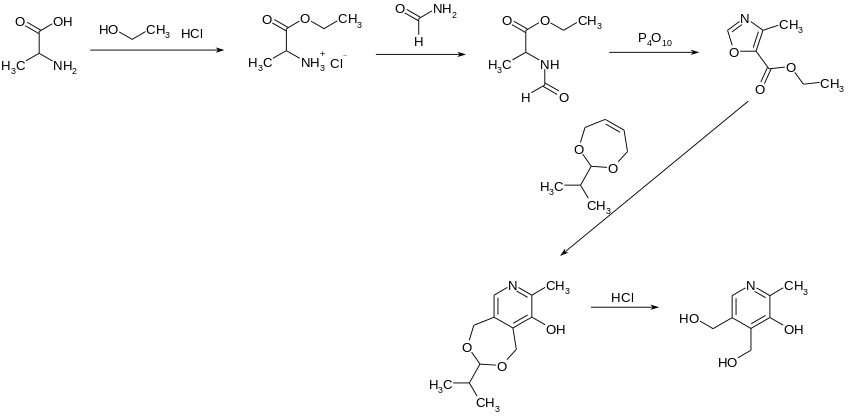
Synthese nach Merck & Co.
Die Firma Merck & Co. beginnt mit racemischem DL-Alanin, das mit Ethanol und HCl zum Ethylesterhydrochlorid verestert wird. Mit Formamid entsteht im nächsten Schritt der N-Formyl-DL-alanin-ethylester, der mit Phosphorpentoxid zum 5-Ethoxy-4-methyloxazol reagiert. Dieses wird mit 2-Isopropyl-4,7-dihydro-1,3-dioxepin, dem Acetal aus 2-Buten-1,4-diol und Isobutyraldehyd, bei 18 °C und anschließender saurer Spaltung zu Pyridoxin umgesetzt.
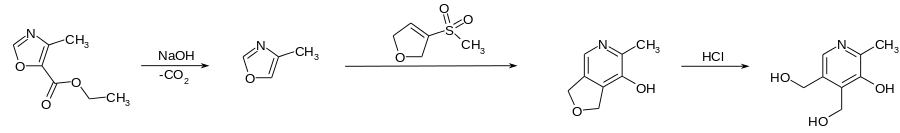
Synthese nach BASF
Bei der Methode der BASF wird der Methyloxazol-5-carbonsäureester zuerst alkalisch gespalten und anschließend unter Wärmezufuhr decarboxyliert. Das entstandene 4-Methyloxazol wird mit 3-Methylsulfonyl-2,5-dihydrofuran zu 6-Methyl-1,3-dihydrofuro[3,4-c]pyridin-7-ol umgesetzt. Dieses wird mit Salzsäure zum Endprodukt gespalten.
Toxizität
Für die Verbindung sind die folgenden Werte für die letale Dosis (LD50), bei der 50 % einer Population von Tieren sterben, bekannt:
- 4000 mg·kg−1 (Ratte peroral)
- 657 mg·kg−1 (Ratte intravenös)
- 645 mg·kg−1 (Maus intravenös)
- 4000 mg·kg−1 (Ratte peroral, Hydrochlorid)
- 530 mg·kg−1 (Ratte intravenös, Hydrochlorid)
- 5500 mg·kg−1 (Maus peroral, Hydrochlorid)
- 660 mg·kg−1 (Maus intravenös, Hydrochlorid)


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 26.01. 2024