Naphthalin
| Sicherheitshinweise | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||
| MAK |
| |||||||||
Naphthalin [naftaˈliːn] (von altgriechisch ναφθα naphtha = Erdöl; Name nach IUPAC: Naphthalen) ist ein farbloser Feststoff mit der Summenformel C10H8, der schon bei Raumtemperatur sublimiert. Es ist ein bicyclischer aromatischer Kohlenwasserstoff mit charakteristischem Geruch nach Mottenpulver/Teer. Naphthalin ist gesundheitsschädlich und umweltgefährlich.
Geschichte
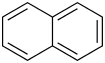
1819 wurde Naphthalin von den britischen Chemikern William Thomas Brande (1788–1866), Alexander Garden († 1829) und John Kidd unabhängig voneinander aus Steinkohlenteer isoliert. Der Name stammt von Kidd. 1826 fand Michael Faraday die Summenformel. 1866 wurde von Emil Erlenmeyer zum ersten Mal die Naphthalinformel aufgestellt. Traditionell wird Naphthalin auch zu den polycyclischen aromatischen Kohlenwasserstoffen (PAK) gezählt. Das Naphthalinmolekül besteht aus zwei anellierten Benzolringen, sein chemisches Verhalten ähnelt dem der anderen PAK.
Vorkommen in der Natur
Spuren von Naphthalin werden von Magnolien und einigen Hirscharten produziert. Außerdem wurde der Stoff bei einer Termitenart nachgewiesen, die es offenbar als Abwehrstoff gegen natürliche Feinde wie Ameisen und giftige Pilze verwendet.
| Strukturformel | ||
|---|---|---|
| ||
| Allgemeines | ||
| Name | Naphthalin | |
| Andere Namen |
Naphthalen (IUPAC) | |
| Summenformel | C10H8 | |
| Kurzbeschreibung | farbloser Feststoff mit Geruch nach Mottenpulver/Teer | |
| Externe Identifikatoren/Datenbanken | ||
| CAS-Nummer | 91-20-3 | |
| EG-Nummer | 202-049-5 | |
| ECHA-InfoCard | 100.001.863 | |
| PubChem | 931 | |
| Eigenschaften | ||
| Molare Masse | 128,17 g/mol | |
| Aggregatzustand | fest | |
| Dichte | 1,14 g/cm3 | |
| Schmelzpunkt | 80,3 °C | |
| Siedepunkt | 218 °C | |
| Löslichkeit | sehr schlecht in Wasser (32 mg/l | |
Gewinnung und Darstellung
Naphthalin wird aus der Mittelölfraktion des Steinkohlenteers (bis zu 11 %), sowie Braunkohlen- und Holzteer, Crackgasöl oder auch aus Kohle, wenn diese verkokt wird, gewonnen. Im Steinkohleteer ist es mengenmäßig die größte Komponente. Es kommt auch in Petroleum und anderen fossilen Energieträgern vor und entsteht auch bei der Verbrennung von Holz oder Tabak. Naphthalin wird von Gaswerksstandorten und Holzimprägnierwerken emittiert, des Weiteren entsteht es auch auf Mülldeponien.
1987 wurde ungefähr eine Million Tonnen Naphthalin produziert. Westeuropa ist mit 250.000 Tonnen der Hauptproduzent von Naphthalin, dann folgen Osteuropa (200.000 Tonnen), Japan (200.000 Tonnen) und die USA (125.000 Tonnen).
Eigenschaften
Physikalische Eigenschaften
In Wasser ist Naphthalin weitgehend unlöslich, bei Raumtemperatur lösen sich nur 0,032 g Naphthalin in einem Liter Wasser. In kurzkettigen Alkoholen ist es schlecht, in unpolaren Lösungsmitteln wie Benzol (1,130 g/l), Kohlenstoffsulfid, Ether, Toluol (910 g/l), Xylol (783 g/l), und Chloroform dagegen gut löslich. Naphthalin bildet weiße Kristallblättchen aus, die bei 80 °C zu einer farblosen Flüssigkeit schmelzen, welche bei 218 °C siedet. Es besitzt einen charakteristischen, intensiv aromatischen teerähnlichen Geruch; die Geruchsschwelle liegt je nach Person bei 0,14 bis 125 mg/m3. Naphthalin hat einen brennenden Geschmack. Die Dämpfe sind brennbar, der Flammpunkt liegt bei 80 °C und die Zündtemperatur bei 540 °C. Die Dichte beträgt 1,14 g/cm3, daher sinkt Naphthalin in Wasser.
Chemische Eigenschaften
Naphthalin verbrennt mit leuchtender, rußender Flamme. Es reagiert heftig mit Oxidationsmitteln wie Chromtrioxid und Stickstoffoxiden. Das chemische Verhalten weist große Ähnlichkeit mit dem von Benzol auf, jedoch ist es aufgrund der Molekülstruktur reaktiver als Benzol, aber weniger reaktiv als tricyclische Aromaten, wie beispielsweise Anthracen. Das Naphthalinmolekül weist 10 π-Elektronen auf. Es geht wie Benzol elektrophile Substitutionsreaktionen ein. Azulen, auch ein aromatischer Kohlenwasserstoff, ist ein Isomer des Naphthalins, es besteht aus einem Fünfer- und einem Siebener-Kohlenstoffring; aufgrund einer dipolaren Struktur ist es jedoch tiefblau und deutlich reaktiver als Naphthalin.
Naphthalin kann unter gemäßigten Bedingungen zu Tetralin (C10H12) hydriert werden. Die weitere Hydrierung unter drastischeren Bedingungen führt zum Decalin (C10H18).
Naphthalin bildet durch Reduktion mit Alkalimetallen in aprotischen Lösemitteln (z.B. Tetrahydrofuran, 1,2-Dimethoxyethan) Alkalinaphthalide. Mit Natrium ergibt sich ein tiefgrünes Salz. Es handelt sich um ein Radikalanion Ketyl, das ein ESR-Signal bei g = 2,0 hat. Das Reduktionspotential beträgt −2,5 V (gegen Standard-Wasserstoffelektrode (SHE)). Ursache der grünen Farbe sind Absorptionsbanden bei 463 und 735 nm.
Das Anion ist eine starke Base, mit protischen Lösemittel reagiert es zu Dihydronaphthalin:
Mit konzentrierter Salpetersäure bildet Naphthalin je nach den gewählten Reaktionsbedingungen 1-Nitronaphthalin oder 2-Nitronaphthalin.
Nachweis
Die Oxidation mit Chromaten und Permanganaten oder großtechnisch mit Sauerstoff an einem Katalysator ergibt Phthalsäure. Naphthalin kann UV-spektroskopisch oder per Hochleistungsflüssigkeitschromatographie nachgewiesen werden. Spuren von Naphthalin werden per Gaschromatographie mit Massenspektrometrie-Kopplung (GC/MS) detektiert.
Verwendung
Früher war Naphthalin der Hauptbestandteil von Mottenkugeln, wird aber heute wegen seines unangenehmen Geruchs oft durch andere Substanzen ersetzt. Des Weiteren ist Naphthalin kaum insektizid wirksam. Auch zur Desinfektion von Insektensammlungen ist es kaum wirksam, obwohl man es lange Zeit dazu verwendete.
Naphthalin kam auch in dem Anfang des 20. Jahrhunderts verwendeten Leuchtgas vor und verstopfte oft die Gasleitungen, da es sich als Feststoff abschied. Trotz seines gesundheitlichen Gefährdungspotenzials wurde es zum Beispiel medizinisch zur Darmdesinfektion verwendet.
Hauptsächlich wird Naphthalin zur Synthese von Phthalsäureanhydrid verwendet, das zu Lösungsmitteln, Kunststoffen und Kraftstoffen weiterverarbeitet wird. Auch zur Herstellung der Lösungsmittel und Kraftstoffzusätze Decalin und Tetralin wird es benötigt, für die Herstellung von Azofarbstoffen, zur Synthese des Holzschutzmittels Chlornaphthalin, von Insektiziden (Carbamaten) sowie von PVC-MolekülmasseWeichmacher-Zwischenprodukten, außerdem zur Herstellung von Alkylnaphthalinsulfaten, die als Seifen benutzt werden. Weitere industriell wichtige Abkömmlinge sind die Naphthole, Bromnaphthaline, Naphthylamine und Nitronaphthaline. Eine weitere Anwendung von Naphthalin ist die als Porenbildner bei der Herstellung von Schleifmitteln.
Biologische Bedeutung
In den Mikrosomen der menschlichen Leberzellen wird Naphthalin von Cytochrom P450 metabolisiert. Die Oxidation führt über die kurzlebige Epoxid-Zwischenstufe zu den primären Metaboliten:
- trans-1,2-Dihydro-1,2-naphthalindiol („Dihydrodiol“)
- 1-Naphthol und
- 2-Naphthol
Der Cytochrom-Untertyp CYP1A2 erzeugt dabei vor allem das Dihydrodiol und 1-Naphthol, während der Untertyp CYP3A4 im Wesentlichen 2-Naphthol produziert. Als sekundäre Metaboliten entstehen aus 2-Naphthol direkt 2,6- und 1,7-Dihydroxynaphthalin. Dagegen werden Dihydrodiol und 1-Naphthol nicht weiter in den Mikrosomen abgebaut.
Sicherheitshinweise
Naphthalin führt auf der Haut zu starken Reizungen und zur Dermatitis. Naphthalin kann die roten Blutzellen schädigen. Beim Einatmen kann es zu Schleimhautreizungen, Kopfschmerzen und Übelkeit, Erbrechen und Verwirrtheitszuständen führen. Bei Einnahme führt es zu Magen-Darm-Störungen, Atemlähmung, Krämpfen und Tremor. Es ist trotz seiner geringen Löslichkeit in Wasser stark wassergefährdend (WGK 3). Eine Schädigung der Augenhornhaut, der Leber und Nieren ist möglich. Zwischen einem Luftvolumenanteil von 0,9 bis 5,9 % bildet es explosive Gemische. Eine krebserregende Wirkung wird vermutet. Die Auswirkungen von Naphthalin auf menschliche Gesundheit und Umwelt werden unter REACH im Jahr 2016 im Rahmen der Stoffbewertung von Großbritannien geprüft.
In Deutschland wurde der Arbeitsplatzgrenzwert von Naphthalin im Jahr 2011 um den Faktor 100 auf 0,5 mg/m3 gesenkt.
Messtechnischer Nachweis
Die Emissionsmessung von Naphthalin kann mittels GC/MS erfolgen. Die Immissionsmessung erfolgt mit hochauflösender Massenspektrometrie (HRMS).
Mittels Biomonitoring ist Naphthalin aufgrund seiner Flüchtigkeit nur mit eingeschränkter Zuverlässigkeit bestimmbar.
Derivate
| Name | Summenformel | Molmasse [g/mol] | Smp. [°C] | Sdp. [°C] | Dichte [g/cm3] | Brechungsindex |
|---|---|---|---|---|---|---|
| 1-Naphthoesäure | C11H8O2 | 172,18 | 157 | 300 | – | |
| 2-Naphthoesäure | C11H8O2 | 172,18 | 182 | - | 1,08 | – |
| 1-Naphthoesäurechlorid | C11H7ClO | 190,63 | 16–19 | 190 (35 Torr) | 1,265 | 1,6552 |
| 1-Naphthol | C10H8O | 144,17 | 94–96 | 278 | 1,224 | – |
| 1-Naphthaldehyd | C11H8O | 156,18 | 1–2 | 160 (15 Torr) | ||
| 1-Nitronaphthalin | C10H7NO2 | 173,17 | 53–57 | 340 | 1,22 | – |
| 1-Fluornaphthalin | C10H7F | 146,16 | −19 | 215 | 1,323 | 1,593 |
| 2-Fluornaphthalin | C10H7F | 146,16 | 61 | 211,5 | - | - |
| 1-Chlornaphthalin | C10H7Cl | 162,62 | −6 | 259 | 1,194 | 1,632 |
| 2-Chlornaphthalin | C10H7Cl | 162,62 | 59,5 | 256 | 1,138 | – |
| 1-Bromnaphthalin | C10H7Br | 207,07 | −2 | 279 | 1,489 | 1,670 |
Siehe auch


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 09.06. 2025