
Magnesiumhydroxid
| Sicherheitshinweise | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| |||||||||
| Toxikologische Daten | 8500 mg/kg (LD50, Ratte, oral)[3] | ||||||||
| Kristallstruktur | ||
|---|---|---|
| ||
| _ Mg2+ _ OH− | ||
| Allgemeines | ||
| Name | Magnesiumhydroxid | |
| Andere Namen | ||
| Verhältnisformel | Mg(OH)2 | |
| Kurzbeschreibung | farb- und geruchloser Feststoff[3] | |
| Externe Identifikatoren/Datenbanken | ||
| CAS-Nummer | ||
| EG-Nummer | 215-170-3 | |
| ECHA-InfoCard | ||
| PubChem | ||
| ChemSpider | ||
| DrugBank | ||
| Arzneistoffangaben | ||
| ATC-Code | ||
| Eigenschaften | ||
| Molare Masse | 58,33 g/mol | |
| Aggregatzustand | fest | |
| Dichte | 2,38 g/cm3 [3] | |
| Schmelzpunkt | 350 °C (Zersetzung)[3] | |
| Löslichkeit | sehr schlecht in Wasser (9 mg/l bei 18 °C)[3] | |
Magnesiumhydroxid ist eine chemische Verbindung des Magnesiums aus der Gruppe der Hydroxide. Es ist ein farbloses Salz und eine starke Base. Aufgrund der geringen Löslichkeit in Wasser hat eine wässrige Anschlämmung aber nur einen pH-Wert von pH ~ 10[3], weshalb Magnesiumhydroxid als scheinbar schwache Base auftritt.
Vorkommen

In der Natur kommt Magnesiumhydroxid als Mineral Brucit vor.[4]
Gewinnung und Darstellung
Magnesiumhydroxid entsteht aus Magnesiumoxid durch Hydratation, analog zum Kalklöschen von Calciumoxid.[5]
Magnesiumhydroxid kann aus Restlaugen der Kaligewinnung durch Ausfällen mit Kalkmilch[4] (1) oder aus Meerwasser durch Ausfällen mit gebranntem Dolomit (2) gewonnen werden. Das Produkt wird anschließend filtriert und bei etwa 100 °C getrocknet. Besonders reines Magnesiumhydroxid entsteht durch Einwirken von Wasser auf elementares Magnesium (3).
(1)
(2)
(3)
Tafelkreide kann neben Calciumsulfat und Calciumcarbonat auch Magnesiumoxid enthalten. Magnesiumhydroxid bildet sich dann beim feuchten Abwischen von Tafelaufschrieben.
Eigenschaften
Magnesiumhydroxid wird durch die Aufnahme von in der Luft enthaltenem Kohlenstoffdioxid nach und nach zu Magnesiumcarbonat umgewandelt.
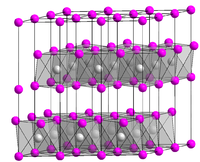
Das Kristallgitter von Magnesiumhydroxid (Brucit) besteht aus einer hexagonal-dichtesten Kugelpackung von Hydroxidionen. Jede zweite Oktaeder-Lückenschicht ist mit Magnesiumionen (Mg2+) besetzt.[4] Dies führt zu einer trigonalen Struktur, Raumgruppe P3m1 (Raumgruppen-Nr. 164), Gitterparameter a = 3,148 Å, c = 4,779 Å.[6] In Wasser und alkalischen Lösungen ist Magnesiumhydroxid schwer löslich, dagegen in sauren Lösungen (beispielsweise Salzsäure, Salpetersäure) gut löslich.[7] Auch in Ammoniumsalzlösungen ist Magnesiumhydroxid gut löslich, da durch die Neutralisation von Ammonium und Hydroxid zu Ammoniak und Wasser nur eine geringe Hydroxid-Konzentration erreicht wird und somit das Löslichkeitsprodukt nicht überschritten wird.[8]
Magnesiumhydroxid bildet mit Säuren basische und neutrale Salze.[8]
Bei Temperaturen oberhalb von 350 °C tritt langsam Zersetzung zu Magnesiumoxid ein.[3] Bei 600 °C liegt das Gleichgewicht praktisch auf der Seite des Oxides.[4]
Verwendung
Der größte Teil des für industrielle Zwecke hergestellten Magnesiumhydroxids wird durch Kalzinieren (Brennen) bei 500–600 °C zu Magnesiumoxid weiterverarbeitet.
Magnesiumhydroxid wird als Speiseölzusatz (zum Abbinden von Schwefeldioxid), als Flockungsmittel für die Abwasseraufbereitung, als Flammschutzmittel in thermoplastischen Kunststoffen (Polyolefinen, PVC) und Elastomeren sowie als Zusatzstoff in Reinigungsmitteln verwendet.
In der Medizin kommt es als Antazidum (Arznei zur Neutralisierung der Magensäure) und als mildes Abführmittel zum Einsatz.[9]
Magnesiumhydroxid wird Lebensmitteln als Säureregulator oder Trennmittel zugesetzt. Es ist in der EU als Lebensmittelzusatzstoff mit der E-Nummer E 528 zugelassen.[10]
Einzelnachweise
- ↑ Eintrag zu
 E 528: Magnesium hydroxide
in der Europäischen Datenbank für Lebensmittelzusatzstoffe.
E 528: Magnesium hydroxide
in der Europäischen Datenbank für Lebensmittelzusatzstoffe.
- ↑ Eintrag zu
 MAGNESIUM HYDROXIDE
in der CosIng-Datenbank der EU-Kommission,.
MAGNESIUM HYDROXIDE
in der CosIng-Datenbank der EU-Kommission,.
- ↑ Hochspringen nach: a b
c d e
f g h
Eintrag zu
 Magnesiumhydroxid in der
GESTIS-Stoffdatenbank des Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung. (JavaScript erforderlich)
Magnesiumhydroxid in der
GESTIS-Stoffdatenbank des Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung. (JavaScript erforderlich)
- ↑ Hochspringen nach: a b c d Arnold Willmes: Taschenbuch chemische Substanzen. 3. Ausgabe. Harri Deutsch Verlag, 2007, ISBN 9783817117871, S. 682.
- ↑ Bonar Marbun: Kinetik der Hydratation von CaO und MgO. Dissertation, Technische Universität
Clausthal, Februar 2006, S. 2 und 4ff. Deutsche Nationalbibliothek
 979684390/34
979684390/34
- ↑ L. Desgranges, G. Calvarin, G. Chevrier: Interlayer interactions in M(OH)2: a neutron diffraction study
of Mg(OH)2. In: Acta Crystallographica, B52, 1996, S. 82–86,
 doi:10.1107/S0108768195008275.
doi:10.1107/S0108768195008275.
- ↑ Erwin Riedel, Christoph Janiak: Anorganische Chemie. 7. Auflage. Walter de Gruyter, 2007, ISBN 9783110189032, S. 605.
- ↑ Hochspringen nach: a b A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1230–1231.
- ↑ Eintrag zu Magnesiumhydroxid. In: Römpp Online. Georg Thieme Verlag.
- ↑
 E 528 – Magnesiumhydroxid,
Homepage der Verbraucherinitiative e. V. zu Lebensmittelzusatzstoffen
E 528 – Magnesiumhydroxid,
Homepage der Verbraucherinitiative e. V. zu Lebensmittelzusatzstoffen


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 18.11. 2025