Furan
| Sicherheitshinweise | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||
| Zulassungsverfahren unter REACH | besonders besorgniserregend: krebserzeugend (CMR) | |||||||||
Furan (Furfuran) ist eine in Wasser schlecht lösliche organische Flüssigkeit aus der Gruppe der aromatischen Sauerstoffheterocyclen bzw. Enolether.
| Strukturformel | |
|---|---|
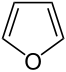 | |
| Allgemeines | |
| Name | Furan |
| Andere Namen |
|
| Summenformel | C4H4O |
| Kurzbeschreibung | farblose Flüssigkeit von chloroformartigem Geruch |
| Externe Identifikatoren/Datenbanken | |
| CAS-Nummer | 110-00-9 |
| EG-Nummer | 203-727-3 |
| ECHA-InfoCard | 100.003.390 |
| PubChem | 8029 |
| ChemSpider | 7738 |
| Eigenschaften | |
| Molare Masse | 68,08 g/mol |
| Aggregatzustand | flüssig |
| Dichte | 0,94 g/cm3 |
| Schmelzpunkt | −86 °C |
| Siedepunkt | 32 °C |
| Dampfdruck |
|
| Löslichkeit | schlecht in Wasser (10 g/l bei 20 °C) |
| Brechungsindex | 1,421 (20 °C) |
| Thermodynamische Eigenschaften | |
| ΔHf0 | −62,3 kJ/mol |
Geschichte
Der Name Furan leitet sich vom lateinischen Wort furfur für Kleie ab. Als erstes Furanderivat stellte der Chemiker Carl Wilhelm Scheele 1780 Furan-2-carbonsäure (Brenzschleimsäure) her. Johann Wolfgang Döbereiner berichtete 1831 von einem weiteren wichtigen Derivat, dem Furfural, neun Jahre später konnte es der schottische Chemiker John Stenhouse charakterisieren. Furan stellte 1870 der Chemiker Heinrich Limpricht her. Er nannte es fälschlicherweise Tetraphenol.
Untersuchungen an Ratten lassen eine genotoxische Wirkung vermuten. In Ratten führt eine Dosis von > 2 mg/kg Körpergewicht zu einer stark erhöhten Tumorrate. Die für den Menschen geschätzte tägliche Aufnahmemenge liegt bei 1,23 µg/kg Körpergewicht. Dies stellt einen geringen Sicherheitsabstand dar. Die Weltgesundheitsorganisation (WHO) hat Furan als möglicherweise Krebs erregend für den Menschen eingestuft. Die genaue Wirkung im menschlichen Körper muss allerdings noch geklärt werden.
Entstehung
Furan ist unter anderem im Kaffee enthalten und entsteht dort als Zersetzungsprodukt aus Furan-2-carbonsäure sowie infolge von Maillard-Reaktionen aus Aminosäuren bzw. Kohlenhydraten. Der Furangehalt ist dabei direkt von der angewandten Brühmethode abhängig. Die gefundenen Konzentrationen liegen dabei zwischen 18 und 88 µg/l in gebrühtem Kaffee.
Gewinnung und Darstellung
Furan wird technisch aus Furfural (Furan-2-carbaldehyd) hergestellt. Dieses kann durch Destillation von Kleie mit Schwefelsäure gewonnen werden. Zur Decarbonylierung (Abspaltung von Kohlenstoffmonoxid) des Furfurals wird es zusammen mit Zinkoxid und Chrom(III)-oxid auf 400 °C erhitzt. In einem alternativen Syntheseweg wird das Furfural zunächst mit Sauerstoff zur Furan-2-carbonsäure oxidiert und anschließend durch eine Decarboxylierung zu Furan umgesetzt. Eine weitere Möglichkeit zur Synthese von Furan und seiner Derivate bietet die Umsetzung von 1,4-Dicarbonylverbindungen (für Furan wird Butandial benötigt) mit trockenem HCl-Gas oder mit Phosphor(V)-oxid.
Eigenschaften
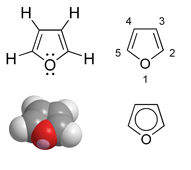
Furan ist ein Aromat: Ein Fünfring mit Sauerstoff als Heteroatom, bei dem sechs π-Elektronen über den Ring delokalisiert sind. Dabei stammen vier Elektronen aus den beiden Doppelbindungen und zwei Elektronen aus dem p-Orbital des sp2-hybridisierten Sauerstoff-Atoms. Somit gehört es zu den Heteroaromaten und zu den Heterocyclen. Der aromatische Charakter ist jedoch schwächer als bei Pyrrol und Thiophen ausgeprägt.
Furan hat einen niedrigen Siedepunkt (32 °C) und schon bei Raumtemperatur einen hohen Dampfdruck. Es ist brennbar und – wegen des hohen Dampfdrucks – hochentzündlich.
Sicherheitstechnische Kenngrößen
Furan bildet leicht entzündliche Dampf-Luft-Gemische. Die Verbindung hat einen Flammpunkt bei −36 °C. Der Explosionsbereich liegt zwischen 2,3 Vol.‑% (64 g/m3) als untere Explosionsgrenze (UEG) und 14,3 Vol.‑% (405 g/m3) als obere Explosionsgrenze (OEG). Die Grenzspaltweite wurde mit 0,68 mm bestimmt. Es resultiert damit eine Zuordnung in die Explosionsgruppe IIB. Die Zündtemperatur beträgt 390 °C. Der Stoff fällt somit in die Temperaturklasse T2.
Verwendung
Eine wichtige Reaktion des Furans ist die Hydrierung zum cyclischen Ether Tetrahydrofuran, der oft als Lösungsmittel verwendet wird.
Derivate
Furanderivate kommen in Aromen und Riechstoffen vor und wirken in der Natur als Pheromone. Furanfettsäuren werden von verschiedenen Pflanzen aus Fettsäuren synthetisiert und lassen sich in einer Vielzahl von Organismen nachweisen.
Ähnliche Strukturen bilden einige Kohlenhydrate (Zucker), diese werden als Furanosen bezeichnet, enthalten jedoch keine Doppelbindungen im Ring.
Verwandte Verbindungen
- Benzofuran, Furan mit einem kondensierten Benzolring
- Dibenzofuran, die Grundstruktur der Stoffklasse der polychlorierten Dibenzofurane
- Furanocumarine>
- Pyrrol, die Entsprechung des Furans, die Stickstoff enthält statt Sauerstoff
- Tetrahydrofuran (THF), die vollständig hydrierte Entsprechung des Furans und ein gebräuchliches Lösungsmittel
- Thiophen, die Schwefel-Entsprechung des Furans
- 2,5-Dimethylfuran


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 12.05. 2025


