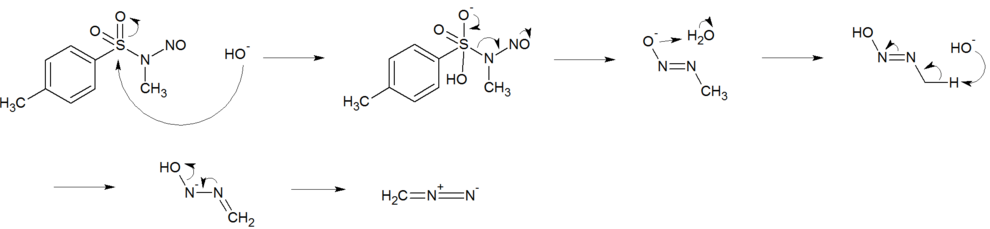Diazomethan
| Sicherheitshinweise | |||||||
|---|---|---|---|---|---|---|---|
| |||||||
| MAK | Schweiz: 0,2 ml/m3 bzw. 0,35 mg/m3 | ||||||
Diazomethan (Summenformel CH2N2), auch Azimethylen genannt, ist die einfachste Diazoverbindung Es ist ein im Labor oft benutztes Methylierungsmittel und wird insbesondere für die Herstellung von Methylestern aus Carbonsäuren und von Cyclopropanen aus Alkenen eingesetzt. Seine technische Anwendung ist durch die hohe Toxizität und Reaktivität sehr begrenzt.
| Strukturformel | ||
|---|---|---|
| ||
| Allgemeines | ||
| Name | Diazomethan | |
| Andere Namen | Azimethylen | |
| Summenformel | CH2N2 | |
| Kurzbeschreibung | gelbes, nach feuchtem Laub riechendes Gas | |
| Externe Identifikatoren/Datenbanken | ||
| CAS-Nummer | ||
| EG-Nummer | 206-382-7 | |
| ECHA-InfoCard | ||
| PubChem | ||
| Eigenschaften | ||
| Molare Masse | 42,04 g/mol | |
| Aggregatzustand | gasförmig | |
| Dichte | 1,45 g/cm3 | |
| Schmelzpunkt | −145 °C | |
| Siedepunkt | −23 °C | |
| Löslichkeit |
| |
Darstellung
Diazomethan lässt sich durch Reaktion von N-Methyl-Nitroso-Verbindungen wie N-Methyl-N-nitrosoharnstoff oder N-Methyl-N-nitroso-p-toluolsulfonamid mit Basen wie Natrium- oder Kaliumhydroxid in Diethylether herstellen.
-
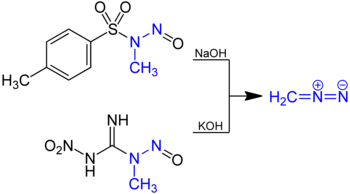
Dabei bildet sich zunächst ein Diazotat, das durch die Base in Diazomethan und Wasser zersetzt wird. Das Diazomethan destilliert man mit dem Ether ab.
Ein anderer postulierter Mechanismus beschreibt eine 1,3-Acylverschiebung mit einer basenkatalysierten Spaltung.
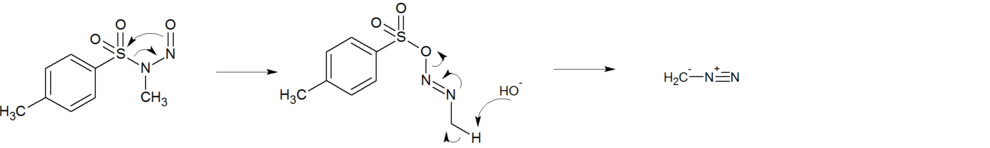
Reaktionsmechanismus der Herstellung von Diazomethan aus Diazald durch 1.3 Acylverschiebung.
Eigenschaften[Bearbeiten | Quelltext bearbeiten]
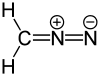
Die Bindungsverhältnisse von Diazomethan lassen sich durch drei mesomere Grenzstrukturen beschreiben:[5]
-
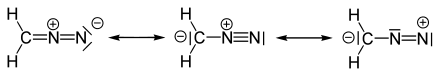
Resonanzstrukturen von Diazomethan
Die isomere ringförmige Verbindung Diazirin, deren Struktur anfangs dem Diazomethan zugeordnet wurde, besitzt völlig andere physikalische und chemische Eigenschaften. Weitere isomere Formen des Diazomethans sind Isoknallsäureamid (H2N-NC) und Isodiazomethan (HCNNH), die nur in komplexstabilisiertem Zustand stabil sind.
Bei Raumtemperatur ist Diazomethan ein gelbes Gas, das nach feuchtem Laub riecht. Es ist sowohl als Gas als auch als Flüssigkeit äußerst explosiv. Darum wird es meist als Lösung in Diethylether hergestellt und verwendet. Die etherische Lösung ist nicht stabil, das Diazomethan zersetzt sich langsam unter Stickstoffabgabe. Explosionsgefahr besteht vor allem bei Kontakt zu rauen Glasoberflächen und Metallen. Diazomethan reagiert mit Alkalimetallen, Calciumchlorid, Kupferpulver und Natriumsulfid explosiv.
Seine chemisch charakteristische Reaktion ist die Methylierung, bei der Diazomethan mit geeigneten Nukleophilen unter Stickstoffabgabe reagiert.
Die Molekülstruktur von Diazomethan wurde mittels Mikrowellenspektroskopie in der Gasphase bestimmt: das Molekül hat C2v-Symmetrie, der C-N-Abstand beträgt 1.300 Å, der N-N-Abstand 1.139 Å, der C-H Abstand 1.077 Å und der H-C-H-Winkel 126.1°.
Toxizität
Diazomethan ist giftig und im Tierversuch krebserzeugend. Der Hauptaufnahmeweg von Diazomethan sind die Atemwege, wo es direkt mit dem Gewebe reagiert. Akut verursacht es Verätzungen, über eine chronische Toxizität ist wenig bekannt.
Verwendung
Diazomethan ist ein starkes Methylierungsmittel und wird ausschließlich als Lösung in Diethylether im kleineren Maßstab verwendet. Es ist ein sehr starkes Elektrophil und besitzt mit N2 eine gute Abgangsgruppe. Es eignet sich insbesondere für die einfache und effektive Herstellung von Methylestern der Carbonsäuren. Die Methylierung ist dabei im Gegensatz zu anderen Methylierungen auch im schwach Sauren möglich. Weiterhin kann es für Ringerweiterungen, die Arndt-Eistert-Homologisierung zur Verlängerung von Kohlenstoffketten um ein weiteres C-Atom und [1,3]-dipolare Cycloadditionen genutzt werden.
Verwendet man Bortrifluorid als Katalysator, so lassen sich mit Diazomethan alkoholische Hydroxygruppen (–OH) in Methoxygruppen (–OCH3) umwandeln. Phenole reagieren mit Diazomethan dagegen auch ohne Bortrifluorid-Katalysator.
Die Addition von Diazomethan an C=C-Doppelbindungen, etwa in Acrylnitril führt zur Bildung von Pyrazolin-Ringen.
Literatur
- Reinhard Brückner: Reaktionsmechanismen. 3. Auflage. Spektrum Akademischer Verlag, München 2004, ISBN 3-8274-1579-9.
- Adalbert Wollrab: Organische Chemie: Eine Einführung für Lehramts- und Nebenfachstudenten. 3. Auflage. Springer, 2009, ISBN 978-3-642-00780-4.
- Hans Peter Latscha, Uli Kazmaier, Helmut Alfons Klein: Organische Chemie: Chemie-Basiswissen II, Band 2. 6. Auflage. Springer, 2008, ISBN 978-3-540-77106-7.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 06.12. 2024