
Knallgas

Knallgas, im englischen Sprachraum auch Oxyhydrogen genannt, ist eine detonationsfähige Mischung von gasförmigem Wasserstoff (H2) und Sauerstoff (O2). Beim Kontakt mit offenem Feuer (Glut oder Funken) erfolgt die sogenannte Knallgasreaktion. Ein fertiges Gemisch aus Wasserstoff und Sauerstoff im Verhältnis 2:1 ist auch in geringen Mengen explosiv. Nutzt man hingegen nur Wasserstoff als Ausgangsprodukt und mischt es mit Luft unter atmosphärischem Druck, muss der Volumenanteil des Wasserstoffs zwischen 4 und 77 % liegen. Werden diese Grenzwerte unter- bzw. überschritten, kommt es nicht mehr zu einer Explosion/Detonation. Durch kontrollierte Verbrennung an einer Mischdüse kann eine kontinuierliche Knallgasflamme erzielt werden.
Die Entstehung von Knallgas beobachteten im 17. Jahrhundert Théodore Turquet de Mayerne (um 1620) und auch Robert Boyle (um 1670) durch Einwirkung von Säuren auf Metalle. Es folgten in den 1770er und 1780er Jahren Henry Cavendish und Joseph Priestley.
Herstellung
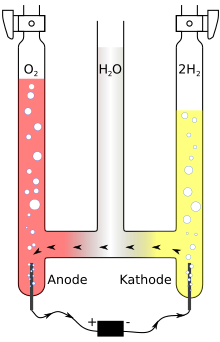
Knallgas lässt sich durch die Wasserelektrolyse, also die elektrolytische Zersetzung von Wasser (H2O) oder durch die thermische Zersetzung von Wasser herstellen. Die thermische Zersetzung von Wasser erfordert Temperaturen oberhalb von 2500 °C.
Bei der Wasserelektrolyse erfolgt die Aufspaltung mit Hilfe von elektrischem Strom. Die Elektroden tauchen in Wasser ein, das durch die Zugabe von etwas Säure, bevorzugt Schwefelsäure, oder Lauge elektrisch leitfähiger gemacht wurde. Sicherheitshalber werden die von den zwei Elektroden hochperlenden Gase getrennt - also der Wasserstoff über der Kathode (Minuspol) - aufgefangen.
Knallgasreaktion
Die Knallgasreaktion ist eine exotherm und detonationsartig ablaufende Reaktion von Wasserstoff mit Sauerstoff und verläuft mit einer Detonationsgeschwindigkeit von 2820 m/s. Sie ist eine Form der Verbrennung (Oxidation).
Die Reaktionsgleichung lautet:
Es handelt sich um eine stark verzweigte Kettenreaktion (Kettenverzweigungsexplosion) unter Beteiligung von Wasserstoff-, Sauerstoff- und Hydroxyl-Radikalen als Kettenträger.
und weitere Reaktionen
Das Reaktionsprodukt ist Wasser.
Die pro molarem Formelumsatz freiwerdende Energie beträgt 571,6 kJ/mol (ΔrH0 = −571,6 kJ/mol). Damit ändert sich die Enthalpie H für ein Mol des entstehenden Wassers um −286 kJ/mol.
Als Nebenreaktion entsteht auch Wasserstoffperoxid gemäß:
Die Knallgas-Reaktion ist stark druck- und temperaturabhängig. Bei sehr
niedrigen Drücken können die entstandenen Kettenträger die Gefäßwand erreichen
und dort rekombinieren. So wird eine Kettenverlängerung oder -verzweigung
unterbunden und es kommt nicht zur Explosion. Wird der Druck erhöht, so erreicht
das Gemisch die untere Explosionsgrenze. Die mittlere freie
Weglänge ist nun so klein geworden, dass die Kettenträger vor Erreichen der
Gefäßwände mit anderen Teilchen zusammenstoßen und die Kettenreaktion
fortführen. Wird der Druck weiter erhöht, so gelangt das System an die obere
Explosionsgrenze. Durch den hohen Druck nimmt die Wahrscheinlichkeit für
Drei-Teilchen-Stöße zu, somit können Kettenträger auch in der Gasphase
rekombinieren und die Kettenreaktion wird abgebrochen. Bei noch höheren Drücken
kommt es schließlich zur thermischen Explosion. Hier kann die bei der Reaktion
freiwerdende Energie nicht mehr schnell genug abgeführt werden und die
Reaktionstemperatur wird erhöht. Dadurch kommt es zu weiteren Reaktionen, deren
Energie wiederum nicht mehr abgeführt werden kann. Die thermische Explosion
beruht also auf einer drastischen Temperaturerhöhung und nicht auf einer
Kettenverzweigungsreaktion.
In den Mitochondrien lebender Zellen kommt es bei der Endoxidation im Komplex IV in der Atmungskette zu einer analogen, aber strikt kontrollierten exergonen Reaktion (gelegentlich, nicht ganz zutreffend, als „biologische Knallgasreaktion“ bezeichnet), die der Energiegewinnung der Zelle, d.. der Bildung von ATP-Molekülen dient:
Die freie Enthalpie ΔG°' der Reaktion ergibt sich aus ihrem Redoxpotential (+0,5 V) und beträgt bei physiologischen Bedingungen (pH 7) −193 kJ/mol.
Die gleiche Reaktion findet auch in der Brennstoffzelle statt. Bei deren Konstruktion wird die bei der Knallgasreaktion freiwerdende Energie (Enthalpiedifferenz), hier genauer: freie Enthalpie oder Gibbs-Energie ΔG genutzt, ohne eine Explosion herbeizuführen. Die dabei freiwerdende Enthalpie wird zum Teil als elektrischer Strom und zum Teil als Wärme freigesetzt. Die Reaktion läuft in der Brennstoffzelle jedoch langsam und kontrolliert ab.
Knallgasprobe
Mit dem Begriff Knallgasprobe bezeichnet man in der Chemie einen Nachweis von Wasserstoff. Dieser ist jedoch unspezifisch, da auch z. B. Methan mit Sauerstoff Knallgas bildet, und dient nur im Chemieunterricht als Pseudonachweis. Die eigentliche Verwendung (siehe unten) ist das Überprüfen des Luftgehaltes einer Wasserstoff produzierenden Apparatur.
Für den Nachweis wird üblicherweise das zu überprüfende Gas in einem Reagenzglas mit der Öffnung nach unten (damit Wasserstoff wegen der geringeren Dichte als Luft nicht entweichen kann) an eine Zündquelle (Bunsenbrenner, Feuerzeug) gehalten.
Fall 1: Das aufgefangene Gas ist reiner Wasserstoff. Es kommt zu einer ruhigen Verbrennung oder eventuell schwachen Verpuffung (negative Knallgasprobe).
Fall 2: Das aufgefangene Gas ist ein Gemisch aus Wasserstoff und Sauerstoff (Knallgas). Die Verbrennung erfolgt mit einem pfeifenden Geräusch (positive Knallgasprobe).
Aufgrund der unterschiedlichen Geräusche bei reinem Wasserstoff und dem Gemisch Wasserstoff mit Sauerstoff wird die Knallgasprobe auch zur Überprüfung der Reinheit von Wasserstoffgas verwendet, um eine Explosion in einem geschlossenen Gefäß zu vermeiden.
Ähnlich wie Knallgas explodiert das Chlorknallgas.
Anwendung

Dass die Knallgasreaktion auch durch einen Platindraht als Katalysator in Gang gesetzt werden kann, entdeckte Johann Wolfgang Döbereiner. Einige Jahre später gelang ihm die Entzündung eines Knallgasgemisches unter dem Einfluss von Platinschwamm. Diese Entdeckung führte zur Erfindung des ersten Feuerzeuges (des Döbereinerschen Platinfeuerzeugs).
Unfälle
Weltweit gab es bereits sehr viele Unfälle durch Knallgas-Explosionen, einige davon auch katastrophalen Ausmaßes. Der dafür oft genannte Absturz des Hindenburg-Zeppelins im Jahr 1937, wo beim Anflug auf den Ankermast durch ein kleineres Leck das Traggas Wasserstoff in die Luft-Atmosphäre entwich und dadurch ein gewaltiger Wasserstoff-Brand verursacht wurde, war keine Knallgasreaktion, weil der Volumenanteil des Wasserstoffs zu hoch und der Sauerstoffkonzentration in der Luft zu niedrig war.
In jüngerer Zeit besonders bekannt wurden Wasserstoff-Explosionen 1986 bei der Katastrophe von Tschernobyl und 2011 bei der Nuklearkatastrophe von Fukushima.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 05.11. 2024