Trimerisierung
Als Trimerisierung, auch Cyclotrimerisierung (manchmal auch Trimerisation oder Cyclotrimerisation), bezeichnet man die Vereinigung von drei Molekülen, den Monomeren, zu einem Trimer. Die dabei entstehenden Stoffe enthalten meist einen Sechsring.
Chemie
In der Chemie handelt es sich im Allgemeinen um die Vereinigung von drei identischen Molekülen zu einem neuen Molekül durch Additionsreaktionen. Das Trimer hat somit die dreifache Molekülmasse des Ausgangsstoffes. Bei der Trimerisierung entstehen oft auch noch Tetramere und höhere Nebenprodukte, eben höhere Oligomere.
Bildung von Alicyclen
Die Cyclotrimerisierung von Acetylen wurde bereits 1866 von Marcelin Berthelot (1827–1907) entdeckt. Dabei entsteht bei 500 °C Reaktionstemperatur und geringer Ausbeute Benzol.
Bessere Ausbeuten erhält man wenn man die Reaktion bei 60–70 °C in Gegenwart von Katalysatoren wie Tricarbonyl(triphenylphosphin)nickel(0) arbeitet.[1] Dabei werden neben 88 % Benzol auch 12 % Styrol gebildet. Diese Chemie basiert auf Arbeiten von Walter Reppe (1892–1969).
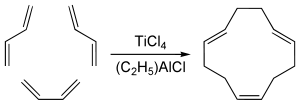
Die Cyclotrimerisierung von Buta-1,3-dien in Gegenwart von Ziegler-Katalysatoren aus Titan(IV)-chlorid und Diethylaluminiumchlorid liefert in bemerkenswert glatter Reaktion (Z,E,E,)-Cyclododecan-1,5,9-trien.[2] Dieses Verfahren geht zurück auf Arbeiten von Günther Wilke.[3][4]
Bildung von Heterocyclen
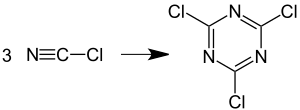
1,3,5-Triazinen (s-Triazine) sind zugänglich durch Trimerisierung von Verbindungen mit einer Dreifachbindung zwischen einem Kohlenstoff- und einem Stickstoffatom. Cyanurchlorid wird durch Trimerisierung von Chlorcyan hergestellt. Cyanurbromid entsteht analog durch die Trimerisierung von Bromcyan.[5] Cyanursäure entsteht analog durch die Cyclotrimerisierung von Isocyansäure.[6]
Die Bildung von 1,3,5-Trioxan (Trioxan) aus Formaldehyd ist ein weiteres Beispiel für die Bildung eines sechsgliedrigen Heterocyclus.[7]
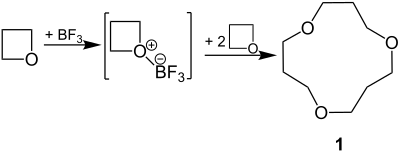
Eine Lewis-Säure, wie Bortrifluorid (BF3), kann an ein nichtbindendes Elektronenpaar am O-Atom des Oxetans addiert werden. In Dichlormethan als Lösungsmittel findet dann eine Cyclooligomerisierung statt. Als Hauptprodukt entsteht der cyclische Ether 1:[8]
Biologie
In der Biologie wird mit Trimerisierung meist das Aneinanderlagern dreier Proteine, der Monomere, zu einem Proteinkomplex bezeichnet.
Man unterscheidet Trimere aus drei gleichen Monomeren, die Homotrimere (z. B. Hämagglutinin), von Trimeren aus verschiedenen Monomeren, den Heterotrimeren (z. B. Kollagen).[9]
Einzelnachweise
- ↑ Siegfried Hauptmann: Organische Chemie, 2. durchgesehene Auflage, VEB Deutscher Verlag für Grundstoffindustrie, Leipzig, 1985, S. 262, ISBN 3-342-00280-8.
- ↑ Klaus Weissermel, Hans-Jürgen Arpe: Industrial Organic
Chemistry. 4. Auflage. Wiley-VCH, Weinheim 2003, ISBN 3-527-30578-5 (
 eingeschränkte Vorschau in der Google-Buchsuche).
eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Siegfried Hauptmann: Organische Chemie, 2. durchgesehene Auflage, VEB Deutscher Verlag für Grundstoffindustrie, Leipzig, 1985, S. 244–245, ISBN 3-342-00280-8.
- ↑ Günther Wilke: Organo Transition Metal Compounds as Intermediates in Homogenous Catalytic Reactions]
(
 PDF; 390 kB).
PDF; 390 kB).
- ↑ F. Oberhauser: Das Verhalten des Bromcyans gegenüber Metallsalzen in
Chem. Ber. 60 (1927) 1434–1439
doi:
 10.1002/cber.19270600628.
10.1002/cber.19270600628.
- ↑ Siegfried Hauptmann: Organische Chemie, 2. durchgesehene Auflage, VEB Deutscher Verlag für Grundstoffindustrie, Leipzig, 1985, S. 613, ISBN 3-342-00280-8.
- ↑ Patentanmeldung
 WO2009077416A1:
Verfahren zur Herstellung von Roh-Trioxan. Angemeldet am 11. Dezember 2008,
veröffentlicht am 25. Juni 2009, Anmelder: BASF SE, Erfinder: Markus Siegert et al.
WO2009077416A1:
Verfahren zur Herstellung von Roh-Trioxan. Angemeldet am 11. Dezember 2008,
veröffentlicht am 25. Juni 2009, Anmelder: BASF SE, Erfinder: Markus Siegert et al.
- ↑ Theophil Eicher, Siegfried Hauptmann, Andreas Speicher: The Chemistry of Heterocycles, Wiley-VCH, 2012, ISBN 978-3-527-32747-8, S. 45–48.
- ↑ Beispiel: Untersuchungen zur Anreicherung von Influenza Hämagglutinin mit einer Hexahistidinsequenz durch
Affinitätschromatographie, 1998; urn:
 nbn:de:kobv:188-1998000401
nbn:de:kobv:188-1998000401


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 01.06. 2024