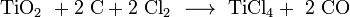Titan(IV)-chlorid
| Sicherheitshinweise | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| |||||||||
Titan(IV)-chlorid (Titantetrachlorid) ist eine chemische Verbindung aus Chlor und Titan. Das Titan liegt in TiCl4 in seiner höchsten und stabilsten Oxidationsstufe vor.
Es sind weitere Chlorverbindungen des Titans, darunter beispielsweise Titan(III)-chlorid, das als ein starkes Reduktionsmittel ist, bekannt.
| Strukturformel | ||
|---|---|---|
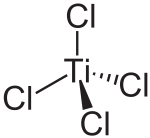 | ||
| Allgemeines | ||
| Name | Titan(IV)-chlorid | |
| Andere Namen | Titantetrachlorid | |
| Summenformel | TiCl4 | |
| CAS-Nummer | ||
| EG-Nummer | 231-441-9 | |
| ECHA-InfoCard | ||
| PubChem | ||
| Kurzbeschreibung | farblose, stechend riechende, an feuchter Luft stark rauchende Flüssigkeit | |
| Eigenschaften | ||
| Molare Masse | 189,71 g/mol | |
| Aggregatzustand | flüssig | |
| Dichte | 1,73 g/cm3 | |
| Schmelzpunkt | −24,8 °C | |
| Siedepunkt | 136,5 °C | |
| Dampfdruck | 12 hPa (20 °C) | |
| Löslichkeit | ||
| Brechungsindex | 1,6076 (18 °C) | |
Herstellung
Titantetrachlorid wird durch Carbochlorierung von Titandioxid in Gegenwart von Kohle und Chlor bei 700–1000 °C hergestellt:
Es ist ein Zwischenprodukt des Kroll-Prozesses zur Herstellung von Titan.
Verwendung
Titantetrachlorid ist eine wichtige Lewissäure und wird in der Organischen Chemie in Knoevenagel-Reaktionen und der Mukaiyama-Michael-Reaktion verwendet. Es ist zudem Grundstoff für Katalysatoren, wie beispielsweise Ziegler-Natta-Katalysatoren, und Ausgangsstoff für Organo-Titan-Verbindungen. Titantetrachlorid findet in Raucherzeugern für militärische Zwecke Verwendung (Nebelkampfstoff). Titantetrachlorid tritt beim „Chloridverfahren“, das der Aufreinigung des Titandioxids dient, als Zwischenprodukt auf. Es wird auch in der nass-analytischen Chemie zum Nachweis von Peroxiden benutzt. Bei Peroxidanwesenheit verfärbt sich die Lösung gelblich bis orange.
Eigenschaften
Titantetrachlorid hydrolysiert mit Wasser in einer heftigen Reaktion zu Titandioxid (Rauch) und Chlorwasserstoff (korrosiv). Bereits bei Kontakt mit Luftfeuchtigkeit findet die Hydrolyse statt.
Wirkung im Körper
Besonders beim militärischen Einsatz als Nebelkampfstoff besteht die Gefahr des Einatmens des entstehenden Chlorwasserstoffes HCl. Dieses kann zu Reizungen oder sogar Verätzungen der Schleimhäute oder des Lungengewebes führen. Erste Symptome beim Einatmen sind Husten und Brustschmerzen. Dauern die Symptome länger als 20 Minuten, ist mit einem lebensbedrohlichen Lungenödem zu rechnen, welches auch ohne anhaltende Symptome auftreten kann.
Einzelnachweise
- ↑ Hochspringen nach:a b Eintrag zu Titan(IV)-chlorid in der GESTIS-Stoffdatenbank des Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung. (JavaScript erforderlich)
- ↑ Eintrag zu Titanium tetrachloride im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA). Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 01.06. 2024