
Ruhemembranpotential
Als Ruhemembranpotential oder auch knapp Ruhepotential (abgekürzt RMP bzw. RP) wird das Membranpotential von erregbaren Zellen in Ruhe bezeichnet, also bei nicht erregten Nervenzellen oder Muskelzellen. Eine charakteristische, vorübergehende Abweichung vom Ruhepotential ist beispielsweise das Aktionspotential (AP) dieser Zellen bei Erregung.
Das Ruhepotential entspricht in guter Näherung dem Diffusionspotential von innerhalb zu außerhalb der Zellen ungleich verteilten Ionen, vorrangig von Kalium (K+) neben Natrium (Na+) und Chlorid (Cl−). Genauer bestimmt wird es durch die Summe der jeweiligen Gleichgewichtspotentiale unter Berücksichtigung der Membranleitfähigkeiten für diese Ionen (siehe auch Goldman-Gleichung). Die als Ruhemembranpotential bezeichnete Potentialdifferenz zwischen negativ geladenem Zellinneren und extrazellulärer Umgebung über die Membran beträgt je nach Zelltyp zwischen −100 und −50 mV, bei den meisten Nervenzellen rund −70 mV. Dieses Ruhepotential einer erregbaren Zelle ist von grundlegender zellphysiologischer Bedeutung, unter anderem für die Erregungsleitung der Nerven, die Steuerung der Muskelkontraktion und den elektrophoretischen Stofftransport durch die Membran.
Das Membranpotential vieler nichttierischer Zellen, so von Pflanzen, Pilzen oder Bakterien, ist wegen der Aktivität einer Protonen (H+) exportierenden ATPase (elektrogene Pumpe) in der Regel wesentlich negativer und liegt oft bei etwa −200 mV. Alle lebenden Zellen haben ein Membranpotential, also eine elektrische Potentialdifferenz oder Spannung über der Plasmamembran zwischen Außen- und Innenraum der Zelle. Doch nur bei erregbaren Zellen dient dessen Veränderung vom Ruhezustand als transmembranes Signal.
Ursachen des Ruhepotentials
Ein Membranpotential ist ein Zeichen lebender Zellen, beim Zelltod verschwindet es. Ein charakteristisches Membranpotential in Ruhe ist ein Kennzeichen erregbarer Zellen, deren Erregung in Veränderungen ihres Membranpotials Ausdruck findet, etwa als Serie von Aktionspotentialen. Dem Ruhemembranpotential liegen Unterschiede in der Verteilung von geladenen Teilchen, Ionen, diesseits und jenseits der Zellmembran zugrunde. Diese ungleiche Ionenverteilung in der Umgebung der Zellmembran tendiert zum Ausgleich, doch die Zellmembran ist durch Öffnungen und verschließbare Kanäle nur für kleine Ionen passiv passierbar und hält die großen, in der Zelle für verschiedene Zwecke gebildeten Proteinmoleküle mitsamt deren Ladungen zurück. Außerdem findet durch Ionenpumpen der Zellmembran ein aktiver Transport statt, der Natriumionen (Na+) aus dem Zellraum schafft und Kaliumionen (K+) in der Zelle anreichert. Die für das Ruhemembranpotential wichtigsten Ionenarten sind diese Kationen K+ und Na+ sowie organische Anionen (A−) in Form von Proteinen neben anorganischen Chloridionen (Cl−).
Bei der Ausbildung eines Ruhemembranpotentials wirken mehrere Faktoren zusammen:
- Chemischer Gradient – Teilchen bewegen sich zufällig und tendieren zu gleichmäßiger Verteilung (Brownsche Molekularbewegung).
- Elektrischer Gradient – elektrische Spannungsunterschiede tendieren zu einem Ausgleich.
- Selektive Permeabilität – bedingte Durchlässigkeit der Zellmembran in Ruhe aufgrund von Ionenkanälen mit jeweils spezifischer Leitfähigkeit für unterschiedliche Ionen: gut durchlässig vor allem für Kalium-Ionen (K+) und – abhängig vom Zelltyp – für Chlorid-Ionen (Cl−), am Ruhepotential weniger durchlässig für Natrium-Ionen (Na+) und Calcium-Ionen (Ca2+) sowie praktisch undurchlässig für organische Anionen.
- Natrium-Kalium-Ionenpumpe – durch Tätigkeit der Natrium-Kalium-ATPase, einer Ionenpumpe, werden aktiv, unter ATP-Hydrolyse, Natrium-Ionen aus der Zelle heraus- und Kalium-Ionen in die Zelle hineingepumpt.
Da der elektrische und der chemische Gradient zwei für die Verteilung von Ionen untrennbare Faktoren darstellen, werden diese oft als elektrochemischer Gradient zusammengefasst.
Diffusionspotential
Das Phänomen des Diffusionspotentials ist nicht nur auf die Biologie beschränkt. Es tritt bespielsweise auch auf, wenn zwei Flüssigkeitsräume als Kompartimente mit unterschiedlich hohen Konzentrationen eines Kaliumsalzes durch eine für Kaliumionen permeable synthetisch hergestellte Membran getrennt sind, die von der negativ geladenen Salzkomponente nicht passiert werden kann.
- Wäre die trennende Schicht auch für Kaliumionen unpassierbar, bliebe die Ausgangslage erhalten; sie ist elektrisch neutral, da zwar auf der einen Seite mehr Kaliumionen, aber auch entsprechend mehr negativ geladene Gegenionen des Salzes vorhanden sind.
- Können nun Kaliumionen durch die Membran treten, so wechseln einige von einer zur anderen Seite, und zwar in beiden Richtungen. Allerdings sind auf der einen Seite wesentlich mehr Ionen als auf der anderen, sodass in der Summe Kaliumionen vom höher in das niedriger konzentrierte Kompartiment übertreten. Triebkraft ist das chemische Potential aufgrund eines Konzentrationsgradienten.
- Doch Kaliumionen besitzen eine Ladung. Sobald ein Ion übertritt, trägt es seine positive Ladung in das eine Kompartiment, während diese dem anderen Kompartiment dann fehlt. Mit der räumlich verschobenen Ladung ist eine Veränderung des elektrischen Feldes verbunden, beziehungsweise eine Änderung der elektrischen Potentialdifferenz oder Spannung über der Membran. Infolge des elektrischen Gradienten dieses Feldes wirkt auf die diffundierenden Ionen eine Kraft, die hier dem Ausgleich des chemischen Gradienten entgegenwirkt.
- Zwischen beiden Kräften bildet sich ein elektrochemisches Gleichgewicht aus, bei dem pro Zeitspanne genauso viele Teilchen in die eine wie in die andere Richtung die Membran passieren. Dieses Gleichgewicht ist genau dann erreicht, wenn der Energieaufwand für den einen Weg gleich dem des anderen ist. Setzt man die Ausdrücke für die elektrische Arbeit und die chemische Arbeit entlang eines Konzentrationsgradienten gleich, erhält man die Nernst-Gleichung. Die konzentrationsabhängige Potentialdifferenz an diesem Punkt ist das sogenannte Gleichgewichtspotential für das betreffende Ion, in diesem Fall für Kalium.
Situation an der Membran
Die biologische Membran erfüllt die Voraussetzungen für ein Diffusionspotential. Die Lipiddoppelschicht ist für Ionen nur in sehr geringem Maße permeabel. In dieser Schicht sitzen Transmembranproteine, die hochspezifische Kanäle für die Kationen K+, Na+, Ca2+ oder für Anionen darstellen. Die Öffnung dieser Kanäle kann durch verschiedene Mechanismen kontrolliert werden, die aber für das Ruhepotential nicht von Bedeutung sind.
Die meisten Kanäle sind während des Zustands des Ruhepotentials geschlossen, nur bestimmte Kaliumkanäle sind offen (beim Menschen je nach Zelltyp die Gruppe der spannungsunabhängigen Kalium-einwärts-Gleichrichter-Kanäle Kir, die 2-P-Domänen- oder Hintergrundkanäle, und ein erst bei sehr negativen Spannungen schließender spannungsabhängiger (KCNQ-Typ-Kalium-) Kanal). Einen weiteren auch im Ruhezustand geöffneten Transporter stellt die Natrium-Kalium-Pumpe dar. Dem Konzentrationsgefälle folgend gelangen über Leckströme durch die Membran ständig geringe Mengen von Natrium-Ionen von außen in die Zelle und Kalium-Ionen von innen in den Extrazellularraum. Dem entgegen pumpt die Natrium-Kalium-Pumpe (Na+-K+-ATPase) unter Verbrauch eines ATPs pro Transportzyklus 3 Na+ hinaus und 2 K+ in die Zelle hinein und baut so einen elektrochemischen Gradienten auf (s. unten). Der bei weitem überwiegende Anteil der Kanäle für Natrium und Calcium ist geschlossen.
| Ion | Konzentration intrazellulär (mmol/l) |
Konzentration extrazellulär (mmol/l) |
Verhältnis | Gleichgewichtspotential nach Nernst |
|---|---|---|---|---|
| Na+ | 7–11 | 144 | 1:16 | ca. +60 mV |
| K+ | 120–155 | 4–5 | 30:1 | −91 mV |
| Ca2+ | 10−5–10−4 | 2 | +125 mV bis +310 mV | |
| Cl− | 4–7 | 120 | 1:20 | −82 mV |
| HCO3− | 8-10 | 26-28 | 1:3 | −27 mV |
| H+ | 10−4 (pH 7,0) | 4×10−5 (pH 7,4) | 2,5:1 | −24 mV |
| Anionische Proteine | 155 | 5 |
Ionenungleichgewicht
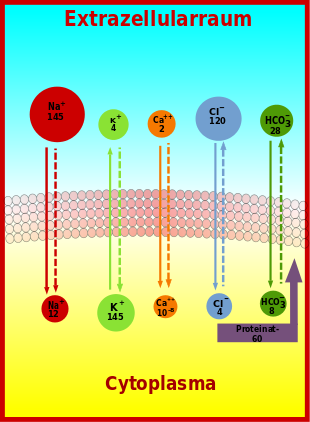
(durchgehende Pfeile geben die Richtung des Konzentrationsgradienten, gestrichelte die Richtung des Potentialgradienten an; die Konzentration von Ca⁺⁺ im Cytoplasma ist in Mol pro Liter angegeben, alle anderen Konzentrationen in mmol/l)
Über die Membran lebender Zellen bestehen für eine Reihe von Ionen große Konzentrationsgradienten. Die für das Ruhemembranpotential wichtigen Konzentrationsgradienten werden durch die besondere Beschaffenheit der Membran und die darin tätige sogenannte Natrium-Kalium-Pumpe aufgebaut, ein energieabhängiges Transportenzym, das als Natrium-Kalium-ATPase pro gespaltenem ATP-Molekül drei Na+-Ionen hinaus und zwei K+-Ionen hinein transportiert. In der Bilanz wird so pro Zyklus eine positive Ladung über die Membran verschoben. Das von der Natrium-Kalium-ATPase erzeugte Ladungsungleichgewicht ist eine wichtige Voraussetzung für das Ruhemembranpotential und wesentlich für dessen Erhaltung.
Ausbildung des Ruhemembranpotentials
Da nun eine selektiv permeable Membran und ein Konzentrationsgradient gegeben sind, kann sich ein Gleichgewichtspotential entwickeln.
Entscheidend für das Ruhemembranpotential ist der Konzentrationsgradient des Kalium-Ions. Das Ruhemembranpotential wird vom Gleichgewichtspotential des Kaliumions bestimmt.
Diese Behauptung gilt trotz der Tatsache, dass das Ruhemembranpotential nie genau bei dem von der Nernst-Gleichung für Kaliumionen vorgegebenen Wert liegt. Der Grund dafür ist, dass die Leitfähigkeit der Membran für Natrium- und Calciumionen zwar sehr gering, aber doch nicht null ist, und beide Ionen weit von ihrem Gleichgewichtspotential (siehe Tabelle) entfernt liegen, was eine hohe elektrochemische Triebkraft bedeutet. Daher gibt es immer Natriumleckströme (in geringerem Maß auch Calcium) ins Zellinnere, die das Potential ins Positive verschieben und wieder Kaliumionen aus der Zelle treiben. Würde nicht beständig die Natrium-Kalium-ATPase gegen diese Leckströme arbeiten, wäre das Ruhepotential schon bald nivelliert.
Die Membran ist in geringem Maße auch für Chloridionen permeabel. Das Gleichgewichtspotential der Chloridionen liegt aber nahe dem für Kaliumionen. Dennoch ist auch das Chloridion am Ruhemembranpotential beteiligt.
Aufgrund der Beteiligung auch anderer Ionen reicht die Nernst-Gleichung für eine genaue Berechnung nicht aus. Eine bessere mathematische Beschreibung ist mit der Goldman-Hodgkin-Katz-Gleichung möglich, die neben Kalium- auch Natrium- und Chloridionen in die Berechnung einbezieht.
Die oben genannten Gleichungen beschreiben einen stationären Zustand des Potentials über der Zellmembran, also das Ruhemembranpotential. Betrachtet man jedoch die Möglichkeit einiger Ionenkanäle, ihre Leitfähigkeit in Abhängigkeit von der anliegenden Spannung zu ändern, wird die Membranleitfähigkeit zu einer Funktion der Spannung über der Membran und es herrscht kein stationärer Zustand mehr. Dies ist im Hodgkin-Huxley-Modell beschrieben, welches die elektrischen Zustände einer oder mehrerer Zellen bei unterschiedlichen Bedingungen beschreibt.
Als Ursachen für diese Gradienten bzw. als Gründe für die Verhinderung eines Diffusionsausgleiches kann man folgende Punkte zusammenfassen:
- Verschiedene Ionen-Permeabilitäten über die Membran.
- Immobilität der intrazellulären Proteine (Gibbs-Donnan-Effekt; nach Frederick George Donnan und Josiah Willard Gibbs).
- Gleichgewichtspotentiale der Ionen (Nernst, Goldman).
- Verschiedene Leitfähigkeiten für die jeweiligen Ionen.
- Die Na-K-Pumpe (elektrogen, konzentrationsverschiebend).
Messung des Ruhemembranpotentials
Das Ruhemembranpotential kann man experimentell mit zwei Mikroelektroden bestimmen. Eine der beiden Mikroelektroden, die Messelektrode, wird in die Zelle hineingestochen, die zweite, die Bezugselektrode, wird von außen an die Zelle gehalten. An einem Voltmeter oder Kathodenstrahloszilloskop kann man zwischen den Elektroden eine Spannung (genauer Potentialdifferenz) in der Größenordnung von −70 mV (viele Säugetiere) ablesen: das Ruhepotential. Definitionsgemäß ist diese Spannung als Spannungsunterschied über die Membran zu verstehen. Das Zellinnere ist negativ geladen.
Die gemessenen Werte sind je nach Zelltyp unterschiedlich und schwanken zwischen −50 und −100 mV. Bei menschlichen Neuronen liegt der Wert typischerweise bei −70 mV, Gliazellen, Herz- und Skelettmuskelzellen weisen −90 mV auf, beim glatten Muskel beläuft sich das Ruhemembranpotential auf ca. −50 mV.
Bedeutung des Ruhepotentials
Die Ausbildung und Aufrechterhaltung eines Ruhepotentials ist die grundlegende Voraussetzung für eine Reihe von Aufgaben der Zellen, für die im Folgenden einige angeführt werden.
Informationsübertragung
Ein vollständig schwarz bedrucktes Blatt Papier stellt keine Informationen dar. Entsprechend würde eine Nervenzelle, die ständig erregt ist (etwa bei +30 mV), keine Information weiterleiten können. Das Ruhepotential ermöglicht sozusagen erst die Erzeugung von Aktionspotentialen und damit die Weiterleitung von elektrischen Informationen an einer Nervenzelle.
Auslösen von Vorgängen
Die durch eine Abweichung vom Ruhepotential übertragene Information kann nicht nur weitergeleitet, sondern auch zum Auslösen verschiedener Vorgänge benutzt werden. So reagieren Muskelzellen auf eine Depolarisation – unter Vermittlung von Calciumionen – mit ihrer spezifischen Aufgabe, nämlich der Kontraktion.
Transportvorgänge
Auch elektrisch nicht erregbare Zellen nutzen ihr Ruhemembranpotential, häufig um bestimmte Substanzen im Zellinneren anzureichern. Das Potential liefert dabei die Energie, die benötigt wird, den Konzentrationsgradienten aufzubauen.
Siehe auch


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 02.10. 2024