Motorprotein
Motorproteine (nicht zu verwechseln mit den Movement-Proteinen einiger Pflanzenviren) sind eine von fünf Funktionsgruppen der Cytoskelettproteine neben den filamentären Gerüstproteinen, Brückenproteinen, Begrenzungsproteinen und Regelproteinen. Sie sind ausgeprägte allosterische Proteine, die vornehmlich unter ATP-Verbrauch der Bewegungserzeugung dienen, teilweise aber auch Regelaufgaben übernehmen. Hauptsächlich werden mit diesen Bewegungen biologische Lasten (Vesikel, Zellorganellen u.a.) transportiert bzw. Cytoskelettelemente gegeneinander verschoben.
Grundlegender Aufbau
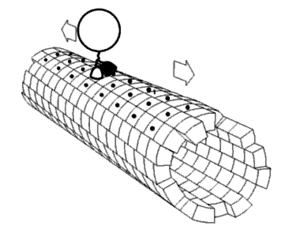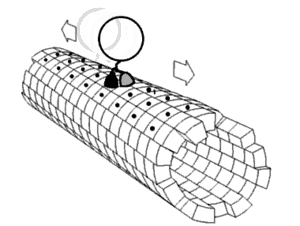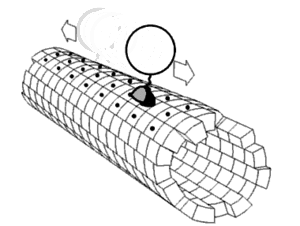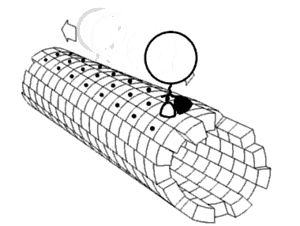
Motorproteine bestehen immer aus einer sogenannten Kopf- (oder Motordomäne) und einer Schwanzdomäne.
Motordomäne
Hiermit bindet sich das Protein an das Cytoskelettelement. In der Motordomäne befindet sich auch die ATP-Bindungsstelle und die Strukturen, die bei der Konformationsänderung die Bewegung des Moleküls ausführen. In den einzelnen Familien von Motorproteinen sind die Motordomänen sehr einheitlich und hoch konserviert.
Schwanzdomäne
Hier befinden sich die Bindungsstellen für die Last, die transportiert werden soll. Der Aufbau der Schwanzdomäne legt außerdem fest, ob sich mehrere Proteine zu größeren Komplexen zusammenlagern können. Der Aufbau der Schwanzdomäne ist sehr variabel.
Motorproteinklassen
- Kinesin: Bindet an Mikrotubuli. Bildet meistens Dimere. Die Bewegungsrichtung von Kinesin ist meistens vom Minus- zum Plusende des Mikrotubulus. Es dient in erster Linie dem Transport von Zellorganellen und Vesikeln. Zum Beispiel werden Vesikel mit Neurotransmittern mittels Kinesin in den Nervenzellen vom Zellkern über das Axon zur Synapse transportiert. Es handelt sich also in den meisten Fällen um einen Transport vom Zellkern zur Zellmembran. Kinesin hat auch wichtige regulatorische Funktionen bei der Zellteilung.
- Dynein: Dyneine bilden meistens Dimere und binden an Mikrotubuli. Sie bewegen sich meistens vom Plus- zum Minusende eines Mikrotubulus (von der Zellmembran zum Zellkern). Es gibt spezielle Arten von Dynein, die im Axonema von Cilien und Geißeln vorkommen.
- Myosin und Tropomyosin: Myosine binden an Aktinfilamente und können hier ebenfalls als Dimere Vesikel oder ähnliches transportieren. Ihre Bewegungsrichtung ist meistens vom Minus- zum Plusende eines Aktinfilaments (Ausnahme: Myosin VI). Weiterhin dienen Myosine dem Verschieben von Cytoskelettelementen gegeneinander. Sie übernehmen deshalb z. B. Funktionen bei der Zelladhäsion, der Endo- und Exocytose, Zellfortbewegung durch Kriechen, im allgemeinen Verformung von Zellen (z. B. Muskelkontraktion) etc. Myosin ist ein Motorprotein, das nur in Eukaryoten vorkommt, hier allerdings immer. Tropomyosin ist dem Myosin ähnlich.
- Prestin: Ein sehr schnell bewegliches Motorprotein der äußeren Haarzellen des
Innenohrs.
Immunolokalisierung zeigt, dass Prestin in den lateralen Plasmamembranen der äußeren Haarzellen zu finden ist. Das ist der Bereich, in dem Elektromotilität auftritt. Prestin (molare Masse: 80 kDa) gehört zur Familie der Anionen-Transporter, SLC26. Die Proteine dieser Familie sind strukturell gut erhalten und können den elektroneutralen Austausch von Chloriden und Karbonaten durch die Plasmamembran von Säugetierzellen vermitteln. Zwei Anionen erweisen sich dabei als wichtig für die Motilität der äußeren Haarzellen. Im Unterschied zu den enzymatisch betriebenen Motorproteinen bewirkt beim Prestin die direkte Umwandlung elektrischer Spannungen eine mechanische Verschiebung. Damit wird eine gegenüber zellulären Motorproteinen um Größenordnungen schnellere Motilität erreicht. Um diese Wirkung entfalten zu können, wird das Protein auf kurzem Weg direkt von den sensorischen Elementen der äußeren Haarzellen angesteuert.
Verwandtschaftsverhältnisse
Durch Strukturanalysen konnte gezeigt werden, dass Myosin und Kinesin einen sehr ähnlichen Kern in der Motordomäne besitzen in dem sich die ATP-Bindungsstelle befindet und die Konformationsänderung des Proteins ihren Anfang nimmt. Es wird deshalb vermutet, dass Myosin und Kinesin einen gemeinsamen evolutionären Ursprung haben, sie bilden eine Proteinfamilie.
Obwohl Kinesin und Dynein Mikrotubuli als Schienensystem verwenden, konnte kein gemeinsamer Ursprung erkannt werden.
Eine funktionelle Verwandtschaft besteht auch zu den G-Proteinen die durch GTP-Verbrauch eine Konformationsänderung durchmachen, diese Konformationsänderung allerdings in erster Linie zur Signalweiterleitung verwenden.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 31.03. 2025