
G-Proteine
Die Bezeichnung G-Protein steht vereinfacht für Guanosintriphosphat-bindendes Protein oder GTP-bindendes Protein. G-Proteine besetzen eine Schlüsselposition in der Signalweiterleitung (Signaltransduktion) zwischen Rezeptor und Second-Messenger-Systemen. Man unterscheidet zwischen membranständigen heterotrimeren G-Proteinen und cytosolischen sogenannten kleinen G-Proteinen.
Heterotrimere G-Proteine
Heterotrimere G-Proteine sind aus drei Untereinheiten (α, β und γ) aufgebaut, wobei die α-Untereinheit eine GDP/GTP-Bindungsdomäne besitzt. In der inaktiven Form hat die α Untereinheit GDP gebunden und ist mit Untereinheiten βγ assoziiert. Ein Heterotrimeres G-Protein kann durch einen G-Protein-gekoppelten Rezeptor, der ein GTP-Austauschfaktor (guanine-nucleotide exchange factor, GEF) ist oder einen solchen bindet, aktiviert werden. Dabei tauscht die α Untereinheit (unter Einwirkung des GEF) ihr gebundenes GDP gegen GTP aus, worauf die α Untereinheit von den Untereinheiten βγ dissoziiert. Die Untereinheiten βγ zerfallen nicht weiter, sondern stellen eine funktionelle Einheit dar. Die beiden freigesetzten G-Proteinuntereinheiten α und βγ können unterschiedliche Effektoren regulieren. Beispiele hierfür sind Adenylylcyclasen, G-Protein-gekoppelte Rezeptorkinasen (GRKs) und Phospholipasen. Von den einzelnen Untereinheiten existieren mehrere Isoformen. Bisher sind 21 unterschiedliche α G-Proteinuntereinheiten, 5 β Untereinheiten und 12 γ Untereinheiten bekannt.
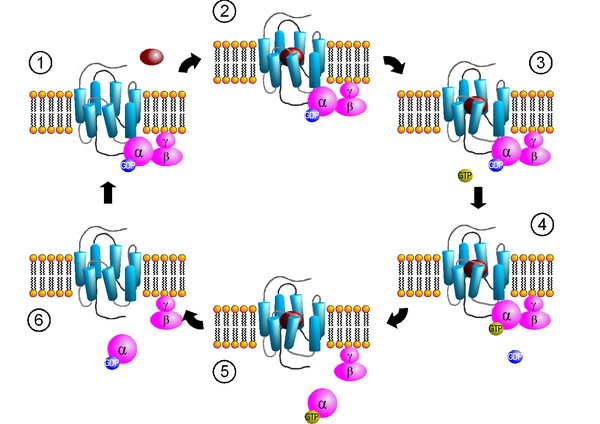
(1) Bindung des G-Proteins; (2) Ligandenbindung; (3) Aktivierung des Rezeptors; (4) Aktivierung des G-Proteins; (5) Dissoziation des G-Proteins und Signaltransduktion; (6) Inaktivierung des G-Proteins
Heterotrimere G-Proteine besetzen eine Schlüsselposition in der Signaltransduktion und sind verantwortlich für physiologische (z.B. Sehen, Riechen, Blutdruckregulation etc.) und pathophysiologische Effekte (z.B. arterielle Hypertonie, Herzinsuffizienz).
Subfamilien
- Gs-Proteine: cAMP-abhängige Reaktionen
- Gi-Proteine: inhibitorische G-Proteine
- Gq-Proteine: Phospholipase-C-gekoppelte G-Proteine
Kleine G-Proteine (monomere)
Kleine G-Proteine (auch kleine GTP-asen) sind monomere GTP-bindende Proteine mit einer Molekülmasse von 20 bis 40 kDa. Derzeit sind über 100 verschiedene kleine G-Proteine bekannt, die auf Grund phylogenetischer Gemeinsamkeiten und Unterschiede in 5 Familien unterteilt werden: Ras, Rho, Rab, Sar1/Arf und Ran. Sie sind im Zellzyklus an der Regulation zahlreicher Zellfunktionen beteiligt, z.B. der Regulation der Genexpression (Ras und Rho), der Regulation des Zytoskeletts (Rho), der Regulation des Vesikeltransports (Rab und Sar1/Arf) sowie der Regulation des Transports zwischen Cytoplasma und Zellkern (Ran). Die kleinen GTPasen gehen von einer inaktiven, GDP-gebundenen Form im Cytosol in eine aktive, GTP-gebundene Form an der Plasmamembran über. Sie werden von 14-3-3-Proteinen gehemmt.
Literatur
- K. Aktories, J. T. Barbieri: Bacterial cytotoxins: targeting eukaryotic switches. In: Nat. Rev. Microbiol. 3, 2005, S. 397–410.
- K. Burridge, K. Wennerberg: Rho and Rac take center stage. In: Cell. 116, 2004, S. 167–179.
- H. E. Hamm: The Many Faces of G Protein Signaling. In: J. Biol. Chem. 273, 2, 1998, S. 669–672.
- A. Ivetic, A. J. Ridley: Ezrin/radixin/moesin proteins and Rho GTPase signalling in leukocytes. In: Immunology. 112, 2004, S. 165–176.
- L. M. Machesky, A. Hall: Rho: a connection between membrane receptor signalling and the cytoskeleton. In: Trends Cell Biol. 6, 1996, S. 304–310.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 27.12. 2024