Phosphinsäure
| Sicherheitshinweise | |||||||
|---|---|---|---|---|---|---|---|
| |||||||
Phosphinsäure, veraltet auch Hypophosphorige Säure genannt, ist eine der Säuren des Phosphors und hat die Summenformel H3PO2. Ihre Salze werden Phosphinate oder (veraltet) Hypophosphite genannt; mit Alkoholen kann Phosphinsäure formal Phosphinsäureester bilden. Der Phosphor hat in diesen Verbindungen die Oxidationsstufe +I.
| Strukturformel | ||
|---|---|---|
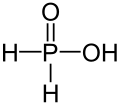
| ||
| Allgemeines | ||
| Name | Phosphinsäure | |
| Andere Namen |
| |
| Summenformel | H3PO2 | |
| Kurzbeschreibung | farb- und geruchlose Blättchen | |
| Externe Identifikatoren/Datenbanken | ||
| CAS-Nummer | ||
| EG-Nummer | 228-601-5 | |
| ECHA-InfoCard |
| |
| PubChem | ||
| ChemSpider | ||
| Eigenschaften | ||
| Molare Masse | 66,00 g/mol | |
| Aggregatzustand | fest | |
| Dichte | 1,49 g/cm3 | |
| Schmelzpunkt | 26,5 °C | |
| Siedepunkt | 108 °C (Zersetzung) | |
| Dampfdruck | 0,43 Pa (25 °C) | |
| pKS-Wert |
| |
| Löslichkeit | löslich in Wasser | |
Herstellung
Erzeugt werden kann Phosphinsäure durch Disproportionierung von weißem Phosphor (P4) in einem alkalischen Medium:
Ebenfalls möglich ist die Darstellung durch Zersetzung von Bariumphosphinat mit Schwefelsäure.
Eigenschaften
Wasserfreie Phosphorinsäure kristallisiert in farblosen Blättchen, die sich in Wasser sehr leicht lösen. Beim Erhitzen auf 130–140 °C tritt Disproportionierung zu Monophosphan und Phosphonsäure ein.
Verwendung
Phosphinsäure kann in wässriger Lösung als Reagenz zur Reduktion von Diazoniumgruppen eingesetzt werden (Dediazonierung). Als Reaktionsprodukte entstehen elementarer Stickstoff und Phosphonsäure.
Siehe auch
Literatur
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 04.08. 2024
