
Diphosphan
| Sicherheitshinweise | |||||||
|---|---|---|---|---|---|---|---|
| |||||||
| Strukturformel | |
|---|---|
 | |
| Allgemeines | |
| Name | Diphosphan |
| Andere Namen |
|
| Summenformel | P2H4 |
| Externe Identifikatoren/Datenbanken | |
| CAS-Nummer | 13445-50-6 |
| PubChem | 139283 |
| Eigenschaften | |
| Molare Masse | 65,98 g/mol |
| Schmelzpunkt | −99 °C |
| Siedepunkt | 52 °C |
| Löslichkeit | schlecht in Wasser |
Diphosphan gehört zu den Phosphanen und ist ein binäres Phosphorhydrid mit der Summenformel P2H4. Oberhalb von −99 °C liegt es als farblose Flüssigkeit vor. An Luft ist es nicht stabil, sondern entzündet sich spontan. Zudem disproportioniert es bei Temperaturen oberhalb von −30 °C zu PH3 und höheren Phosphanen. Es kommt häufig als Verunreinigung in kommerziell erhältlichem Monophosphan vor.
Herstellung
Diphosphan kann durch Hydrolyse von Calciummonophosphid (Ca2P2) gewonnen werden:
Dabei ergibt die Hydrolyse von 400 g Ca2P2 bei −30 °C etwa 20 g P2H4. Als Verunreinigung fallen weitere Phosphane an.
Eigenschaften und Reaktionen
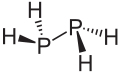
Diphosphan ist eine farblose, an der Luft selbstentzündliche Flüssigkeit, die sich in Gegenwart von Säurespuren, bei Temperaturen oberhalb von −10 °C (vor allem unter der Einwirkung des Lichtes) sowie an rauhen Oberflächen zersetzt. Sie ist mischbar mit Kohlenstoffdisulfid, Pyridin, Kohlenwasserstoffen, Ethern, Diethylenglycolmonomethylether, Diethylenglykoldimethylether, Hexamethylphosphorsäuretriamid, und löslich in Methanol. Sie liegt in Gauche-Konformation vor, mit einem P-P-Abstand von 2,219 Ångström. Das 1H NMR-Spektrum besteht aus 32 Linien aus der A2XX'A'2 Aufspaltung.
Die Reaktion von Diphosphan mit Butyllithium führt zu verschiedenen kondensierten Polyphosphanen.
Organische Diphosphane
Es sind verschiedene organische Derivate von Diphosphan bekannt. Dabei sind einige oder alle Wasserstoffatome durch Organylreste substituiert. Ihre Synthese erfolgt durch reduktive Kupplung z. B. aus Chlordiphenylphosphan:
Das Methylderivat P2Me4 erhält man durch Reaktion von Thiophosphoryltrichlorid mit Methylmagnesiumbromid.


© biancahoegel.de;
Datum der letzten Änderung: Jena, den: 05.05. 2024