Lithiumoxid
| Sicherheitshinweise | |||||||
|---|---|---|---|---|---|---|---|
| |||||||
Lithiumoxid ist eine chemische Verbindung, die aus Lithium und Sauerstoff aufgebaut ist. Es wird zur Herstellung von Lithiumniobat sowie als Zusatzstoff in Keramiken und Gläsern benutzt.
| Kristallstruktur | |
|---|---|
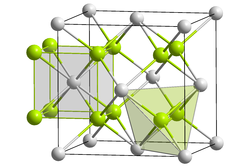 | |
| _ Li+ _ O2− | |
| Allgemeines | |
| Name | Lithiumoxid |
| Andere Namen | Dilithiumoxid, Lithia |
| Verhältnisformel | Li2O |
| Kurzbeschreibung | weißer, geruchloser Feststoff |
| Externe Identifikatoren/Datenbanken | |
| CAS-Nummer | 12057-24-8 |
| EG-Nummer | 235-019-5 |
| ECHA-InfoCard | 100.031.823 |
| PubChem | 166630 |
| ChemSpider | 145811 |
| Eigenschaften | |
| Molare Masse | 29,88 g/mol |
| Aggregatzustand | fest |
| Dichte | 2,01 g/cm3 |
| Schmelzpunkt | 1427 °C |
| Löslichkeit | reagiert mit Wasser |
Gewinnung und Darstellung
Lithiumoxid kann durch Verbrennung von Lithium oder durch thermische Zersetzung von Lithiumperoxid oder Lithiumhydroxid hergestellt werden.
Eigenschaften
Lithiumoxid ist ein weißer, geruchloser Feststoff. Er hat eine Kristallstruktur vom Anti-Flussspat-Typ (a = 4,611 Å). Die Standardbildungsenthalpie von Lithiumoxid beträgt ΔHf0 = −599,1 kJ/mol.
Verwendung
Lithiumoxid dient als Ausgangsstoff zur Herstellung von Lithiumniobat. Des Weiteren kann es als Zusatzstoff zur Herstellung von Keramiken und Gläsern eingesetzt werden. Auch in Fusionsreaktoren kann es eingesetzt werden.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 04.03. 2022
