
Phenylhydrazin
| Sicherheitshinweise | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| |||||||||
| MAK | Schweiz: 5 ml/m3 bzw. 22 mg/m3[4] | ||||||||
| Toxikologische Daten | 188 mg/kg (LD50, Ratte, oral)[1] | ||||||||
Phenylhydrazin ist eine chemische Verbindung aus der Gruppe der aromatischen Hydrazine. Es ist eine gelbliche Flüssigkeit, die sich an Luft zunehmend dunkelrot bis rotbraun färbt.
| Strukturformel | ||
|---|---|---|
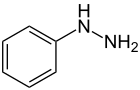
| ||
| Allgemeines | ||
| Name | Phenylhydrazin | |
| Andere Namen |
| |
| Summenformel | C6H8N2 | |
| Kurzbeschreibung | rotbraune Flüssigkeit mit aromatischem Geruch[1] | |
| Externe Identifikatoren/Datenbanken | ||
| CAS-Nummer | ||
| EG-Nummer | 202-873-5 | |
| ECHA-InfoCard | ||
| PubChem | ||
| ChemSpider | ||
| Eigenschaften | ||
| Molare Masse | 108,14 g/mol | |
| Aggregatzustand | flüssig | |
| Dichte | 1,1 g/cm3[1] | |
| Schmelzpunkt | 19,6 °C[1] (24 °C für das Hemihydrat) | |
| Siedepunkt | 244 °C[1] (teilweise Zersetzung) | |
| Dampfdruck | 6 Pa bei 20 °C[1] | |
| Löslichkeit | ||
Geschichte
Phenylhydrazin wurde als erste aromatische Hydrazinverbindung durch Emil Fischer im Jahre 1875 untersucht.[5] Er stellte es durch Reduktion von Phenyldiazoniumsalzen mit Sulfitsalzen dar. Fischer nutzte Phenylhydrazin zur Untersuchung der Struktur von Kohlenhydraten durch Bildung von Hydrazonen aus der Aldehydgruppe der Zucker.
Vorkommen
Phenylhydrazin kommt natürlich in einigen Pflanzen[2] (Lorbeerbaum) vor.[6][7] Phenylhydrazine wurden auch in Pilzen (zum Beispiel Agaricus bisporus) nachgewiesen.[8][9]
Gewinnung und Darstellung
Phenylhydrazin wird kommerziell durch Diazotierung von Anilin mit anschließender Reduktion des Diazoniumkations z. B. durch Natriumsulfit gewonnen.[10] Im Jahr 1998 betrug die Produktionsmenge in Westeuropa 6650 Tonnen.[2]
Eigenschaften
Phenylhydrazin bildet monokline Kristalle und schmilzt bei Raumtemperatur zu einer öligen Flüssigkeit. Es zersetzt sich bei einer Temperatur von mehr als 260 °C. Die mittels DSC bestimmte Zersetzungswärme beträgt −71 kJ/mol bzw. −662 kJ/kg.[11] Seine Dämpfe sind viermal so schwer wie Luft. Es ist ein starkes Reduktionsmittel und leicht löslich in Wasser.
Verwendung
Phenylhydrazin wird als Zwischenprodukt zur Herstellung von Indolen verwendet (Fischersche Indolsynthese), die wiederum Zwischenprodukte für die Synthese verschiedener Farbstoffe, Agrochemikalien und Pharmazeutika sind. Es dient ebenfalls als Ausgangsstoff zur Herstellung von Entwicklern für die Fototechnik.[12]
Weiterhin kann es als Reagenz zum Nachweis bzw. zur Identifizierung von Verbindungen mit Carbonylgruppen dienen (Bildung von Phenylhydrazonen oder Osazonen).[13] Der Einsatz von Phenylhydrazin als Laborchemikalie (analytische Reagenz für Aldehyde, Ketone und Zucker (Phenylhydrazinprobe) durch Bildung der gut kristallisierenden Phenylhydrazone oder Osazone, zum Nachweis von Molybdän und anderen Metallen) ist mit einer Derivatisierung verbunden.
Sicherheitshinweise
Phenylhydrazin ist selbstentzündlich, wenn es verunreinigt wird oder in Kontakt mit Stoffen mit großer Oberfläche (z. B. Putzwolle oder Sand) kommt. Seine Dämpfe können beim Erhitzen über seinen Flammpunkt (89 °C) mit Luft ein explosionsfähiges Gemisch bilden. Phenylhydrazin gilt als krebserzeugend, ist ein starkes Blutgift (Methämoglobinbildung) und verursacht auf der Haut Ekzeme.[14] Darüber hinaus führt es zu einer irreversiblen Schädigung des Blutfarbstoffs und der Erythrocyten.[1]
Verbindungen und Derivate des Phenylhydrazins
- 1-Acetyl-2-phenylhydrazin ein Derivat sowohl der Essigsäure, wie auch des Phenylhydrazins
- Phenicarbazid
- Phenylhydrazin·Hydrochlorid C6H8N2·HCl[15]
- Phenylhydrazinsulfat[16]
- 2,4-Dinitro-phenylhydrazin
- 2,4-Dinitro-Phenylhydrazone Derivate zum chemischen Nachweis von Carbonylgruppen in Aldehyden und Ketonen
Regulierung
Über den Safe Drinking Water and Toxic Enforcement Act of 1986 besteht in Kalifornien seit 1. Juli 1992 eine Kennzeichnungspflicht für Produkte, die Phenylhydrazin oder eines seiner Salze enthalten.[17]
Einzelnachweise
- ↑ Hochspringen nach: a b
c d e
f g h
i j Eintrag zu
 Phenylhydrazin in der GESTIS-Stoffdatenbank
des Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung.
Phenylhydrazin in der GESTIS-Stoffdatenbank
des Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung.
- ↑ Hochspringen nach: a b
c Concise International Chemical Assessment Document (CICAD) für
 Phenylhydrazine,
Phenylhydrazine,
- ↑ Eintrag zu
 Phenylhydrazine im
Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA).
Hersteller bzw. Inverkehrbringer können die harmonisierte
Einstufung und Kennzeichnung
Phenylhydrazine im
Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA).
Hersteller bzw. Inverkehrbringer können die harmonisierte
Einstufung und Kennzeichnung  erweitern.
erweitern.
- ↑ Schweizerische Unfallversicherungsanstalt (Suva):
 Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 100-63-0 bzw. Phenylhydrazin)
Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 100-63-0 bzw. Phenylhydrazin)
- ↑ E. Fischer:
 Über aromatische Hydrazinverbindungen. In:
Ber. Dtsch. Chem. Ges. Band 8, 1875, S. 589–594.
Über aromatische Hydrazinverbindungen. In:
Ber. Dtsch. Chem. Ges. Band 8, 1875, S. 589–594.
- ↑ Martin Jacobson: Glossary Of Plant Derived Insect
Deterrents. CRC Press, 2019, ISBN 978-1-351-08072-9, S. 65
(
 eingeschränkte Vorschau in der Google-Buchsuche).
eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Nora Saim, Clifton E. Meloan: Compounds from leaves of bay (Laurus nobilis L.)
as repellents for Tribolium castaneum (Herbst) when added to wheat flour. In: Journal of Stored Products Research.
Band 22,
Nr. 3, 1986,
S. 141–144,
doi:
 10.1016/0022-474X(86)90007-X.
10.1016/0022-474X(86)90007-X.
- ↑ V. Schulzová, J. Hajslová, R. Peroutka, J. Gry, H. C. Andersson:
Influence of storage and household processing on the agaritine content of the cultivated Agaricus mushroom. In:
Food Additives and Contaminants. Band 19,
Nr. 9, 2002,
S. 853–862,
doi:
 10.1080/02652030210156340,
10.1080/02652030210156340,
 PMID 12396396.
PMID 12396396.
- ↑ Nordic Council of Ministers:
 Phenylhydrazines in the Cultivated Mushroom
(Agaricus bisporus) : - occurrence, biological properties, risk assessment and recommendations.
Phenylhydrazines in the Cultivated Mushroom
(Agaricus bisporus) : - occurrence, biological properties, risk assessment and recommendations.
- ↑ G. H. Coleman:
 Phenylhydrazine In: Organic Syntheses. 2, 1922, S. 71,
doi:
Phenylhydrazine In: Organic Syntheses. 2, 1922, S. 71,
doi: 10.15227/orgsyn.002.0071; Coll. Vol. 1, 1941, S. 442
(
10.15227/orgsyn.002.0071; Coll. Vol. 1, 1941, S. 442
( PDF)
PDF)
- ↑ T. Grewer, O. Klais: Exotherme Zersetzung - Untersuchungen der charakteristischen Stoffeigenschaften. (= Humanisierung des Arbeitslebens. Band 84). VDI-Verlag, Düsseldorf 1988, ISBN 3-18-400855-X, S. 9.
- ↑ Bundesagentur für Arbeitsschutz und Arbeitsmedizin: Datenblatt
 Phenylhydrazin,
automatischer Download.
Phenylhydrazin,
automatischer Download.
- ↑
 Reaktionen bioorganischer Verbindungen (PDF; 605 kB).
Reaktionen bioorganischer Verbindungen (PDF; 605 kB).
- ↑ Siegfried Hauptmann: Organische Chemie. 2. Auflage. VEB Deutscher Verlag für Grundstoffindustrie, Leipzig 1985, ISBN 3-342-00280-8, S. 522.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu Phenylhydraziniumchlorid:
CAS-Nummer:
 59-88-1, EG-Nummer: 200-444-7,
ECHA-InfoCard:
59-88-1, EG-Nummer: 200-444-7,
ECHA-InfoCard:
 100.000.404,
GESTIS-Stoffdatenbank:
100.000.404,
GESTIS-Stoffdatenbank:
 490069,
PubChem:
490069,
PubChem:
 60962,
ChemSpider:
60962,
ChemSpider:
 54924.
54924.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu Phenylhydrazinsulfat:
CAS-Nummer:
 52033-74-6,
EG-Nummer: 257-622-2,
ECHA-InfoCard:
52033-74-6,
EG-Nummer: 257-622-2,
ECHA-InfoCard:
 100.052.367,
GESTIS-Stoffdatenbank:
100.052.367,
GESTIS-Stoffdatenbank:
 144330,
PubChem:
144330,
PubChem:
 6452561,
ChemSpider:
6452561,
ChemSpider:
 4954989.
4954989.
- ↑
 Phenylhydrazin. OEHHA, 1. Juli 1992.
Phenylhydrazin. OEHHA, 1. Juli 1992.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 19.02. 2025


