
Phosphortrichlorid
| Sicherheitshinweise | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||
| MAK |
| |||||||||
Phosphortrichlorid oder Phosphor(III)-chlorid ist eine farblose, giftige und stark ätzende Flüssigkeit von stechendem Geruch, die an feuchter Luft infolge von Hydrolyse raucht.
| Strukturformel | ||
|---|---|---|
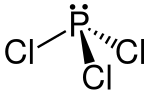
| ||
| Allgemeines | ||
| Name | Phosphortrichlorid | |
| Andere Namen |
| |
| Summenformel | PCl3 | |
| Kurzbeschreibung | farblose, an feuchter Luft rauchende Flüssigkeit mit stechendem Geruch | |
| Externe Identifikatoren/Datenbanken | ||
| CAS-Nummer | ||
| EG-Nummer | 231-749-3 | |
| ECHA-InfoCard | ||
| PubChem | ||
| ChemSpider | ||
| Eigenschaften | ||
| Molare Masse | 137,33 g/mol | |
| Aggregatzustand | flüssig | |
| Dichte | 1,57 g/cm3 (21 °C) | |
| Schmelzpunkt | −93,6 °C | |
| Siedepunkt | 76 °C | |
| Dampfdruck | 133,3 hPa (21 °C) | |
| Löslichkeit |
| |
| Brechungsindex | 1,5122 (21 °C) | |
Herstellung
Es entsteht bei der direkten Umsetzung von Chlor mit weißem Phosphor, P4, neben geringen Mengen Phosphorpentachlorid, PCl5. Letzteres reagiert mit überschüssigem Phosphor ebenfalls zu Phosphortrichlorid.
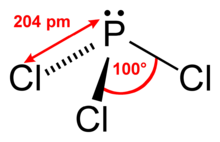
Eigenschaften
Phosphortrichlorid ist das Säurechlorid der phosphorigen Säure, einem dyadischen Tautomer der Phosphonsäure. Infolgedessen erfolgt mit Wasser die Hydrolyse zu dieser und Chlorwasserstoff: Die Hydrolysereaktion verläuft mit einer spezifischen Reaktionsenthalpie von −286,9 kJ·mol−1 stark exotherm.
Hydrolyse des Phosphor(III)-chlorids zu phosphoriger Säure / Phosphonsäure
Auf analoge Weise bilden sich mit Alkoholen Phosphorigsäureester. Dabei werden die Chlor-Atome schrittweise substituiert:
Umsetzung von Phosphortrichlorid mit Methanol – schrittweise Substitution
Analog erfolgen die Umsetzungen mit Aminen, Thiolen oder (Pseudo-)Halogeniden.
Phosphortrichlorid ist ein recht starkes Reduktionsmittel und wird als Sauerstoff-Akzeptor eingesetzt. Dabei bildet sich als Oxidationsprodukt Phosphorylchlorid, das als Verunreinigung Phosphorchlorid begleitet, wenn dieses mit Luft in Berührung kommt.
Phosphortrichlorid lässt sich weiter zum Phosphorpentachlorid chlorieren:
Verwendung
Phosphortrichlorid ist ein Grundstoff der chemischen Industrie, der vielfältige Verwendung findet. Man benötigt es für die Herstellung anderer Phosphorderivate wie Insektizide, Pharmazeutika, Di- und Trialkylphosphite, Phosphorylchlorid, Thiophosphorylchlorid, Flammschutzmittel u.v.a.m.
Im Labormaßstab kann man mit Hilfe von Phosphortrichlorid Carbonsäurechloride darstellen, eine Methode, die gegenüber der Darstellung mittels Thionylchlorid oder Oxalylchlorid allerdings keine Vorteile birgt.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 10.11. 2023


