Gallium(III)-chlorid
| Sicherheitshinweise | |||||||
|---|---|---|---|---|---|---|---|
| |||||||
Gallium(III)-chlorid ist eine chemische Verbindung des Galliums und zählt zu den Chloriden. Die Lewis-Säure liegt als Dimer vor und wird in organischen Reaktionen eingesetzt.
| Kristallstruktur | ||
|---|---|---|
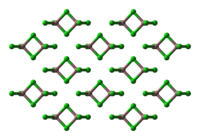
| ||
| _ Ga3+ _ Cl− | ||
| Kristallsystem | monoklin | |
| Raumgruppe | C2/m (Nr. 12) | |
| Gitterparameter | a = 11,948 Å, b = 6,855 Å, c = 7,050 Å, β = 125,69° | |
| Allgemeines | ||
| Name | Gallium(III)-chlorid | |
| Andere Namen | Galliumtrichlorid | |
| Verhältnisformel | GaCl3 | |
| Kurzbeschreibung | weißer Feststoff | |
| Externe Identifikatoren/Datenbanken | ||
| CAS-Nummer | ||
| EG-Nummer | 236-610-0 | |
| ECHA-InfoCard | ||
| PubChem | ||
| Eigenschaften | ||
| Molare Masse | 176,08 g/mol−1 | |
| Aggregatzustand | fest | |
| Dichte | 2,47 g/cm3 | |
| Schmelzpunkt | 77,9 °C | |
| Siedepunkt | 201,3 °C | |
| Löslichkeit | reagiert heftig mit Wasser | |
| Thermodynamische Eigenschaften | ||
| ΔHf0 | −525 kJ/mol | |
Gewinnung und Darstellung
Gallium(III)-chlorid lässt sich direkt aus den Elementen Gallium und Chlor:
durch Umsetzung von elementarem Gallium im HCl-Strom:
oder durch Einwirkung von Thionylchlorid auf Gallium(III)-oxid bei etwa 200 °C gewinnen:
Eigenschaften
Gallium(III)-chlorid bildet wie andere Halogenide der dritten Hauptgruppe Dimere der Form Ga2Cl6 mit vier endständigen und zwei überkappten Chloratomen. Im Festkörper liegen diese analog zur Aluminium(III)-bromid-Struktur in Form kantenverknüpfter Tetraeder vor (monokline Kristallstruktur, Raumgruppe C2/m (Raumgruppen-Nr. 12), a = 11,948 Å, b = 6,855 Å, c = 7,050 Å, β = 125,69°. Dies steht im Gegensatz zur Struktur des Aluminium(III)-chlorides, das eine Schichtstruktur bildet.
Gallium(III)-chlorid ist stark hygroskopisch und reagiert stark mit Wasser. Beim Eindampfen einer wässrigen Lösung wird Chlorwasserstoff abgegeben. Wie andere Halogenide von Aluminium, Gallium und Indium ist Gallium(III)-chlorid eine starke Lewis-Säure. Mit entsprechenden Lewis-Basen wie Halogenidionen, Ethern, Aminen oder Phosphanen bildet es stabile Lewis-Säure-Base Addukte. Gallium(III)-chlorid reagiert dabei im Vergleich mit Aluminium(III)-chlorid mit weichen Lewis-Basen (etwa Phosphane) besser, während harte Lewis-Basen besser mit Aluminium(III)-chlorid reagieren.
Im Vakuum lässt es sich bereits unterhalb seines Schmelzpunktes sublimieren und somit aufreinigen.
Verwendung
Gallium(III)-chlorid wird im Gegensatz zu vielen anderen Galliumverbindungen in der Technik genutzt, es dient als Lewis-Säure in Friedel-Crafts-Reaktionen.
Im GALLEX-Experiment zum Nachweis von Neutrinos wurde eine Lösung von 100 Tonnen Gallium(III)-chlorid in Salzsäure genutzt.
Gallium-68-Chlorid kann zur Skelettszintigrafie mittels Positronenemissionstomographie eingesetzt werden. Dabei wird zwar wegen der hohen Positronen-Reichweite des Ga-68 nicht die mit F-18 (als Natriumfluorid) erreichbare Ortsauflösung erreicht, dafür benötigt man mit dem Gallium-68-Generator kein Zyklotron.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 06.02. 2024
