Acetessigester
| Sicherheitshinweise | |||||||
|---|---|---|---|---|---|---|---|
| |||||||
| MAK | noch nicht eingestuft | ||||||
Acetessigester ist eine chemische Verbindung aus der Gruppe der Ketoester. Es handelt sich um den Ethylester der 3-Oxobutansäure (Acetessigsäure).
| Strukturformel | ||
|---|---|---|
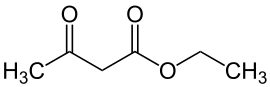
| ||
| Allgemeines | ||
| Name | Acetessigester | |
| Andere Namen | ||
| Summenformel | C6H10O3 | |
| Kurzbeschreibung | farblose Flüssigkeit mit fruchtigem Geruch | |
| Externe Identifikatoren/Datenbanken | ||
| CAS-Nummer | ||
| EG-Nummer | 205-516-1 | |
| ECHA-InfoCard | ||
| PubChem | ||
| ChemSpider | ||
| Eigenschaften | ||
| Molare Masse | 130,14 g/mol−1 | |
| Aggregatzustand | flüssig | |
| Dichte | 1,03 g/cm3 (20 °C) | |
| Schmelzpunkt | −44 °C | |
| Siedepunkt | 180 °C | |
| Dampfdruck |
| |
| Löslichkeit | leicht in Wasser (116 g/l bei 20 °C) | |
| Brechungsindex | 1,4171 (20 °C) | |
Gewinnung und Darstellung
Der klassische Syntheseweg über Carbonylchemie ist die Claisen-Kondensation des Ethylacetats. Die Darstellung wurde erstmals 1863 durch Johann Georg Anton Geuther beschrieben. Modernere technische Prozesse erzeugen Acetessigester aus Ethanol und Diketen. Die Synthese verläuft mit einer Reaktionsenthalpie von −127 kJ/mol exotherm.
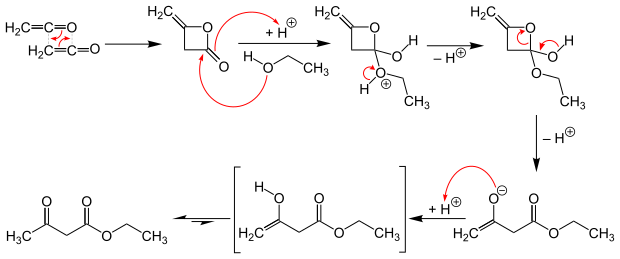
Eigenschaften
Acetessigester ist eine farblose, leicht ölige Flüssigkeit, die bei Normaldruck bei 180 °C siedet. Die Dampfdruckfunktion ergibt sich nach Antoine entsprechend log10(P) = A−(B/(T+C)) (P in bar, T in K) mit A = 5,16327, B = 2189,547 und C = −29,184 im Temperaturbereich von 302 bis 454 K. Die molare Verdampfungsenthalpie beträgt 52,2 kJ/mol. Acetessigester zeigt eine ausgeprägte Keto-Enol-Tautomerie (in n-Hexan liegen 46 % des Acetessigesters, in Ethanol 12 % und in Wasser 0,4 % als Enol vor).
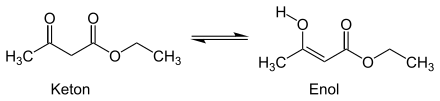
Es handelt sich um eine C–H-acide Verbindung, pKs = 11, da das Enolat-Anion stark mesomeriestabilisiert ist.
Die aktivierte Methylengruppe zwischen den beiden Carbonylfunktionen ist sehr reaktiv und lässt sich alkylieren, acylieren und halogenieren. So funktionalisierte Acetessigesterderivate können mit konzentrierter Lauge in Carbonsäuren gespalten werden und mit Säuren bildet sich ein Keton.
Acetessigester bildet bei höheren Temperaturen entzündliche Dampf-Luft-Gemische. Die Verbindung hat einen Flammpunkt bei 65 °C. Die untere Explosionsgrenze (UEG) liegt bei 1,0 Vol.‑% (54 g/m3). Die Zündtemperatur beträgt 350 °C. Der Stoff fällt somit in die Temperaturklasse T2.
Verwendung
Acetessigester ist durch die funktionellen Gruppen Ausgangsmittel für organische Synthesen wie die Hantzschsche Dihydropyridinsynthese und die Japp-Klingemann-Reaktion. Er wird auch als Lösungsmittel eingesetzt.
Analytik
Eisen(III)-chlorid-Lösung färbt eine wässrige Acetessigesterlösung durch Komplexbildung violett:
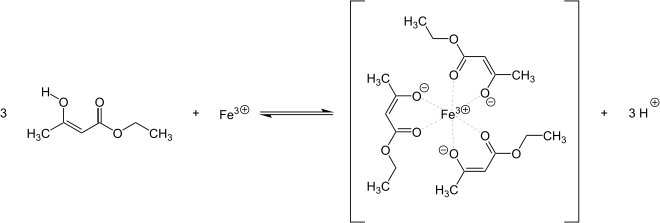
Die Reaktion ist wenig spezifisch, weil andere enolisierbare β-Ketocarbonsäuren (wie z.B. Salicylsäure) und deren Ester die gleiche Reaktion zeigen.
Acetessigester wird in der Baustoffanalytik zur Bestimmung von freiem Calciumoxid (CaO) in Flugaschen oder Zement (Bestimmung nach Franke) eingesetzt.
Literatur
- Hans Beyer, Wolfgang Walter: Lehrbuch der Organischen Chemie, 23. Auflage; S. Hirzel Verlag, Stuttgart – Leipzig 1998; ISBN 3-7776-0808-4.
- Franke, L., Bentrup, H.: Einfluß von Rissen auf die Schlagregensicherheit von hydrophobiertem Mauerwerk und Prüfung der Hydrophobierbarkeit in Bautenschutz + Bausanierung 1991.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 17.10. 2024
