
Kupfer(II)-acetat
| Sicherheitshinweise | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| |||||||||
| MAK | 0,1 mg/m3 | ||||||||
| Toxikologische Daten | |||||||||
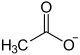
Kupfer(II)-acetat (auch Grünspan; lateinisch Cuprum aceticum oder Aerugo, früher auch viride aeris oder aes viride) ist ein Kupfersalz der Essigsäure mit der Konstitutionsformel Cu(CH3COO)2.
Die Bezeichnung „Grünspan“ (spätmittelhochdeutsch spāngrüen oder grüenspān) ist nach mittellateinisch viride Hispanum („Spanisches Grün“; früher auch „Yspanicum“, „spanisch Grün“, „Spangrün“ und „Kupferrost“ genannt) gebildet, weil der aus künstlich hergestelltem essigsaurem Kupferoxid gewonnene Farbstoff im Mittelalter aus Spanien eingeführt wurde. Diese Bezeichnung ist in soweit irreführend, als nur das wasserfreie Salz von grüner Farbe ist. Sobald es mit Wasser in Berührung kommt, verfärbt es sich wie unten zu sehen zum für Kupfer-(II)-ionen typischen Blau.
| Strukturformel | |
|---|---|
 | |
| Allgemeines | |
| Name | Kupfer(II)-acetat |
| Andere Namen | |
| Summenformel | C4H6CuO4 |
| Kurzbeschreibung | grüne (wasserfrei) bis blaugrüne (Monohydrat), geruchlose Kristalle |
| Externe Identifikatoren/Datenbanken | |
| CAS-Nummer |
|
| EG-Nummer | 205-553-3 |
| ECHA-InfoCard | 100.005.049 |
| PubChem | 8895 |
| ChemSpider | 8555 |
| Eigenschaften | |
| Molare Masse | 181,64 g/mol (wasserfrei)
199,64 g/mol−1 (Monohydrat) |
| Aggregatzustand | fest > |
| Dichte | 1,88 g/cm3 (Monohydrat) |
| Schmelzpunkt | 115 °C (Monohydrat) |
| Siedepunkt | Zersetzung |
| Löslichkeit | mäßig in Wasser (72 g/l bei 20 °C, Monohydrat) |
Eigenschaften
_acetate_partly_powdered.jpg)

-acetate.jpg)
Kupfer(II)-acetat kristallisiert aus wässriger Lösung als Monohydrat (Cu(CH3COO)2·H2O). Das Salz bildet dunkelgrüne Kristalle, die sich in Wasser (bei 20 °C zu 72 g/l) und in Ethanol lösen. Die Kristalle verwittern an der Luft und verlieren beim Erhitzen auf über 100 °C ihr Kristallwasser. Ab 220 °C zersetzt sich das Salz, wobei Kupfer(I)-oxid, Kupfer(II)-oxid, Aceton, Acetaldehyd, Kohlenmonoxid und Kohlendioxid als Zersetzungsprodukte entstehen.
Herstellung
Kupferacetat entsteht im Labor beim Einstellen von Kupferblech oder -draht in Essigsäure oder Essig an der Luft. Dabei bildet sich zunächst sogenannter Grünspan, der ein Gemisch verschiedener basischer Kupferacetate darstellt und sich an Kupferstellen bildet, die sich oberhalb der Essigsäurelösung befinden. Grünspan entsteht daher auch beim Aufbewahren von essighaltigen Speisen in Kupfergefäßen. Grünspan (ungefähre Zusammensetzung Cu(CH3COO)2·[Cu(OH)2]3·2H2O) darf jedoch nicht mit den grünen Schichten einer Patina verwechselt werden, dies sind nämlich Kupfer-(carbonat-sulfat-chlorid)-hydroxid-Gemische (basische Kupferverbindungen), die sich z.B. auf Kupferdächern bilden.
In Essigsäure gelöst, liefert Grünspan dann das Kupferacetat (früher auch Kupferrauch genannt). Bei der technischen Gewinnung von Kupferacetat mit Essigsäure wird statt Kupfer-Metall Kupfer(II)-oxid oder basisches Kupfercarbonat (CuCO3·Cu(OH)2) verwendet.
Verwendung
Kupferacetat ist ein Farbpigment (Spanisches Grün) in den Farben Grün (auch Grünspan) bis Blau (in Gemisch mit Kalk und Essigsäure, es bildet sich Kupfer-Calcium-Acetat). In der Ölmalerei wurde es vor allem in der Renaissance als eines der wenigen damals erhältlichen grünen Pigmente verwendet. Es ist ein wichtiges Zwischenprodukt zur Herstellung des giftigen Farbpigments Schweinfurter Grün, dient als Fungizid (pilztötendes Mittel) und ist mäßig giftig. Im Bengalischen Licht und in Feuerwerken liefert es eine grüne Flammenfärbung.
In der Heilkunde fand Kupfer(II)-acetat etwa mittels der Ägyptischen Grünspan-Salbe (Unguentum aegyptiacum) ein Einsatzgebiet.
Vorkommen
In der Natur kommt Kupferacetat als das sehr seltene Mineral Hoganit vor.
Siehe auch


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 13.12. 2024


