
Arginin
| Sicherheitshinweise | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| |||||||||
| Toxikologische Daten | 5110 mg/kg (LD50, Ratte, oral) | ||||||||
L-Arginin ist eine proteinogene α-Aminosäure. Für den Menschen ist sie semi-essentiell. Der Name leitet sich vom lateinischen Wort argentum (Silber) ab, da die Aminosäure zuerst als Silber-Salz isoliert werden konnte. Diese Aminosäure hat den höchsten Masseanteil an Stickstoff von allen proteinogenen Aminosäuren. Im Dreibuchstabencode wird L-Arginin mit Arg und im Einbuchstabencode als R abgekürzt.
Enantiomere
Arginin besitzt ein Stereozentrum, somit existieren zwei chirale Enantiomere.
In den Proteinen kommt ausschließlich L-Arginin [Synonym: (S)-Arginin] peptidisch gebunden vor. Enantiomer dazu ist das spiegelbildliche D-Arginin [Synonym: (R)-Arginin], das in Proteinen nicht vorkommt. Racemisches Arginin [Synonyma: DL-Arginin und (RS)-Arginin] besitzt geringe Bedeutung.
Wenn in Texten oder in der wissenschaftlichen Literatur „Arginin“ ohne weiteren Namenszusatz (Präfix) erwähnt wird, ist L-Arginin gemeint.
| Strukturformel | |
|---|---|
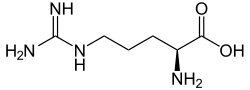 | |
| Strukturformel von L-Arginin, dem natürlich vorkommenden Enantiomer | |
| Allgemeines | |
| Name | Arginin |
| Andere Namen |
|
| Summenformel |
|
| Kurzbeschreibung | weißer Feststoff |
| Externe Identifikatoren/Datenbanken | |
| CAS-Nummer |
|
| EG-Nummer | 200-811-1 |
| ECHA-InfoCard | 100.000.738 |
| PubChem | 6322 |
| ChemSpider | 6082 |
| DrugBank | DB00125 |
| Arzneistoffangaben | |
| ATC-Code |
|
| Eigenschaften | |
| Molare Masse |
|
| Aggregatzustand | fest |
| Dichte | 0,7 g/cm3 |
| Schmelzpunkt | 238 °C |
| pKs-Wert |
|
| Löslichkeit | gut in Wasser (150 g/l bei 20 °C) |
| Enantiomere von Arginin | ||
| Name | L-Arginin | D-Arginin |
| Andere Namen | (S)-Arginin | (R)-Arginin |
| Strukturformel | 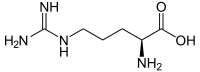 |
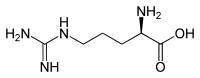 |
| CAS-Nummer | 74-79-3 | 157-06-2 |
| 7200-25-1 (Racemat) | ||
| EG-Nummer | 200-811-1 | 205-866-5 |
| 230-571-3 (Racemat) | ||
| ECHA-Infocard | 100.000.738 | 100.005.334 |
| 100.027.793 (Racemat) | ||
| PubChem | 6322 | 71070 |
| 232 (Racemat) | ||
| DrugBank | DB00125 | DB04027 |
| − (Racemat) | ||
Vorkommen
L-Arginin ist weit verbreitet. Die folgenden Beispiele geben einen Überblick über Arginingehalte und beziehen sich jeweils auf 100 g des Lebensmittels, zusätzlich ist der prozentuale Anteil von gebundenem Arginin am Gesamtprotein angegeben.
| Lebensmittel | Protein | Arginin | Anteil |
|---|---|---|---|
| Buchweizenkörner | 13,25 g | 982 mg | 7,4 % |
| Erbsen, getrocknet | 24,55 g | 2188 mg | 8,9 % |
| Erdnuss, geröstet | 23,68 g | 2832 mg | 11,9 % |
| Hähnchenbrustfilet, roh | 21,23 g | 1436 mg | 6,8 % |
| Hühnerei | 12,57 g | 820 mg | 6,5 % |
| Kuhmilch, 3,7 % Fett | 3,28 g | 119 mg | 3,6 % |
| Kürbiskerne | 30,23 g | 5353 mg | 17,7 % |
| Lachs, roh | 20,42 g | 1221 mg | 6,0 % |
| Mais-Vollkornmehl | 6,93 g | 345 mg | 5,0 % |
| Pinienkerne | 13,69 g | 2413 mg | 17,6 % |
| Reis, ungeschält | 7,94 g | 602 mg | 7,6 % |
| Schweinefleisch, roh | 20,95 g | 1394 mg | 6,7 % |
| Walnüsse | 15,23 g | 2278 mg | 15,0 % |
| Weizen-Vollkornmehl | 13,70 g | 642 mg | 4,7 % |
Alle diese Nahrungsmittel enthalten praktisch ausschließlich chemisch gebundenes L-Arginin als Proteinbestandteil, jedoch kein freies L-Arginin.
Geschichte
L-Arginin wurde 1886 erstmals durch den deutschen Chemiker Ernst Schulze und seinen Doktoranden Ernst Steiger aus Lupinenkeimlingen isoliert. 1894 gelang dann dem schwedischen Chemiker Sven Gustaf Hedin die Isolierung von Arginin aus tierischem Material durch die hydrolytische Spaltung von Hornsubstanz. Durch einen Vergleich seines „tierischen“ Arginins mit ihm zur Verfügung gestellten Proben aus dem Labor Schulzes gelang Hedin der Nachweis der Übereinstimmung der beiden Substanzen.
Eigenschaften
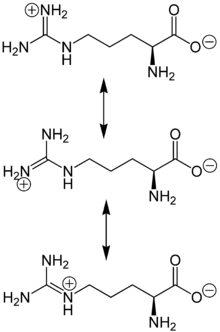
Arginin ist eine α-Aminosäure, die in ihrer Seitenkette eine hydrophile, basisch reagierende Guanidinogruppe enthält. Diese liegt im sauren, neutralen und schwach basischen Milieu protoniert vor, wobei die positive Ladung zwischen den Aminogruppen delokalisiert ist. Gemeinsam mit L-Lysin und L-Histidin gehört L-Arginin zur Gruppe der basischen Aminosäuren oder Hexonbasen.
Arginin liegt überwiegend als „inneres Salz“ bzw. Zwitterion vor, dessen Bildung dadurch zu erklären ist, dass das Proton der Carboxygruppe zum Guanidino-Rest wandert, der stärker basisch als die α-Aminogruppe ist.
Im elektrischen Feld wandert das Zwitterion nicht, da es als Ganzes ungeladen ist. Genaugenommen ist dies am isoelektrischen Punkt (bei einem bestimmten pH-Wert, hier 10,8) der Fall, bei dem das Arginin auch seine geringste Löslichkeit in Wasser besitzt.
Freies L-Arginin hat einen bitteren Geschmack.
Biosynthese
Im Harnstoffzyklus entsteht L-Arginin aus Carbamoylphosphat, L-Ornithin und L-Aspartat.
Industrielle Herstellungsverfahren
Für die Herstellung von L-Arginin gibt es zwei Verfahren:
- „Extraktion“ aus Protein-Hydrolysaten von Gelatine, Haaren oder Federn. Dabei wird das Protein-Hydrolysat (Aminosäuregemisch) durch Kristallisation und Ionenaustauscherchromatographie getrennt und so – neben anderen proteinogenen Aminosäuren – L-Arginin isoliert.
- Fermentation.
Das dabei erhaltene L-Arginin kann ggf. in einem weiteren Produktionsschritt durch Umsetzung mit Salzsäure in das stabilere L-Arginin-Hydrochlorid umgewandelt werden.
Funktionen
L-Arginin ist eine Quelle energiereicher Stickstoff-Phosphat-Verbindungen in Organismen und ist an zahlreichen biologischen Funktionen beteiligt. Es dient in Keimlingen und Speicherzellen als Stickstoff-Reservoir. L-Arginin ist ein Metabolit des Harnstoffzyklus, in dem das Ammoniak, das beim Abbau von Stickstoffverbindungen (z.B. Aminosäuren) entsteht, in Harnstoff umgewandelt wird. L-Arginin ist die alleinige Vorstufe von Stickstoffmonoxid (NO), einem der kleinsten Botenstoffe im menschlichen Körper. Durch Stickstoffmonoxid (NO)-Synthase entsteht aus L-Arginin der Endothelium-derived relaxing Factor (EDRF), der als NO identifiziert wurde. EDRF führt physiologisch zu einer Gefäßerweiterung, indem das NO in die Muskelschicht der Gefäße diffundiert. Es aktiviert dort die lösliche Guanylatcyclase und führt so zur Erschlaffung der glatten Muskulatur und zum Nachlassen des Gefäßtonus. Studien zeigen, dass Arginin über diese Gefäßerweiterung einen erhöhten Blutdruck signifikant senken kann.
Aufgrund der gefäßerweiternden Funktion findet Arginin im Bodybuilding als sogenanntes „Pump-Supplement“ Anwendung. Weiterhin führt das NO zur Hemmung der Thrombozytenaggregation und -adhäsion. Dadurch wird die Bereitschaft für thrombotische Veränderungen an Gefäßplaque-Rupturen herabgesetzt, dem häufigsten Grund für zerebrale Insulte. Es wird angenommen, dass Arginin die unterdrückte Immunantwort bei schweren Verletzungen, Mangelernährung, Sepsis und nach Operationen positiv beeinflussen kann. Bei zusätzlicher Gabe werden eine verbesserte zelluläre Immunantwort, eine Abnahme verletzungsbedingter Funktionsstörungen der T-Zellen und eine verstärkte Phagozytose beobachtet. Zusätzlich wird die Ausbildung der endothelialen Dysfunktion (gestörten Gefäßfunktion) verhindert.
1998 erhielten die Wissenschaftler Robert F. Furchgott, Louis J. Ignarro und Ferid Murad für die Erforschung des Zusammenhangs von Arginin und NO den Nobelpreis für Medizin.
Neue Studien zeigen zudem, dass eine Supplementation mit Arginin die Freisetzung von Insulin aus den beta-Zellen der Pankreas fördern kann und gleichzeitig die Insulinresistenz signifikant verringert. Neben der positiven Wirkung von L-Arginin auf die Glucosetoleranz sowie auf Insulinsensitivität und -produktion führt eine L-Arginin-Supplementation zusätzlich zu einem verbesserten antioxidativen Status.
Arginin antagonisiert die gefährlichen Wirkungen von asymmetrischem Dimethylarginin (ADMA) auf die Blutgefäße. ADMA entkoppelt die Stickstoffmonoxid-Bildung, wodurch eine endotheliale Dysfunktion mit nitrosativem und oxidativem Stress ausgelöst wird.
Bedarf
Der Mensch kann innerhalb des Harnstoffzyklus Arginin selbst synthetisieren, allerdings sind die entstehenden Mengen nicht ausreichend, um den Bedarf vor allem bei heranwachsenden Menschen vollständig zu decken. Daher ist L-Arginin für Kinder essentiell. Aber auch bei Erwachsenen wird der Bedarf an L-Arginin durch die körpereigene Produktion oft nicht ausreichend abgedeckt. Besonders in der Wachstumsphase, durch Stress, bei diversen Krankheiten (z.B. Arteriosklerose, Bluthochdruck, erektile Dysfunktion, Gefäßerkrankungen) oder nach Unfällen übersteigt der Bedarf an Arginin die vom menschlichen Organismus produzierte Menge Auch im Alter steigt der Bedarf an L-Arginin stark an, da der endogene Gegenspieler, das asymmetrische Dimethylarginin (ADMA), um den Faktor 4 ansteigt und damit 40-fach erhöhte Argininkonzentrationen zur Neutralisierung der gefährlichen Effekte dieses Sterblichkeitsfaktors benötigt werden.> Diese Mengen können nur durch eine diätetische Zufuhr gedeckt werden. Entscheidend für den Bedarf an L-Arginin sind daher auch Faktoren wie oxidativer und nitrosativer Stress sowie die ADMA-Spiegel und damit das L-Arginin-ADMA-Verhältnis.
Bei einer Proteinzufuhr von etwa 70–90 g/Tag ergibt sich eine rechnerische tägliche Argininzufuhr von ca. 1–5 g/Tag.
Medizinische Verwendung
L-Arginin wird zur Behandlung einer schweren metabolischen Alkalose verwendet. In der Kinderheilkunde ist L-Arginin auch zur Behandlung eines durch eine schwere angeborene Stoffwechselstörung bedingten erhöhten Ammoniakgehaltes im Blut (Hyperammonämie) angezeigt. Diagnostisch wird L-Arginin zur Abklärung eines Wachstumshormonmangels bei Minderwuchs eingesetzt.
Als (semi)essentielle Aminosäure ist L-Arginin obligatorischer Bestandteil einer parenteralen Ernährung. In Elektrolyt-Konzentraten zum Zusatz zu Infusionslösungen und in peroralen Diätetika wird L-Arginin ebenfalls eingesetzt.
Pharmazeutisch verwendet wird meistens das L-Arginin-Hydrochlorid.
Arginin wird auch als Zusatz in Zahnpasta verwendet. Verglichen mit einer herkömmlichen Zahnpasta mit Fluoridzusatz wurde eine verbesserte Remineralisierung mit einer Kombination aus Arginin, Calciumcarbonat und Fluorid nachgewiesen.
Supplemente
Arginin wird zur Supplementierung bei unzureichender Zufuhr oder erhöhtem Bedarf als diätetisches Lebensmittel, insbesondere als Lebensmittel für besondere medizinische Zwecke, gemäß Diätverordnung für verschiedene Krankheitszustände wie erektile Dysfunktion, Arteriosklerose im Frühstadium, Funktionsstörungen der Blutgefäß-Innenwand (endotheliale Dysfunktion) und Bluthochdruck vermarktet. Diese Indikationen sind für die diätetische Behandlung von Erkrankten etabliert. Ob bei Patienten mit bestehender Herzschwäche die Einnahme von Arginin die körperliche Belastbarkeit oder die Lebensqualität verbessert, bleibt offen – die Ergebnisse einer kleinen, placebokontrollierten Studie verneinen dies.
Die Verwendung gesundheitsbezogener Angaben (health claims), die hingegen den Beitrag von L-Arginin auf gesunde Menschen zur Unterstützung des Kreislaufsystems (Aufrechterhaltung einer normalen Durchblutung, eines gesunden Blutdrucks und der Hämatopoese), zur Unterstützung und Verbesserung der Erektion sowie zur Kräftigung der Muskeln und zur Bereitstellung von Stickoxid im Stoffwechsel betreffen, beurteilte die europäische Behörde für Lebensmittelsicherheit (EFSA) 2011 als wissenschaftlich nicht gerechtfertigt. Einzelne Arbeiten bestätigen die gesundheitsfördernden Wirkungen von L-Arginin bei Gesunden ebenso wie bei Arteriosklerose, endothelialer Dysfunktion und Bluthochdruck und empfehlen die Aminosäure zur Therapie der Herz-Kreislauf-Erkrankungen zugrundeliegenden Stoffwechselstörungen, Hierbei wurde eine signifikante Senkung des Blutdrucks festgestellt, wie auch in der Placebogruppe. Die Halbwertszeit nach der oralen Einnahme von 6 Gramm L-Arginin liegt bei 1,5 bis 2 Stunden.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 04.12. 2025
