
Salzbrücke
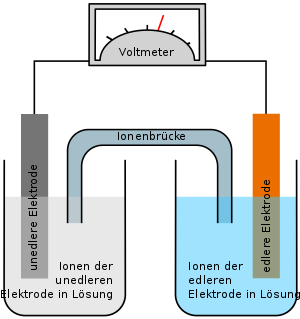
Eine Salzbrücke, auch Ionenbrücke, Elektrolytbrücke oder Stromschlüssel genannt, dient als ionenleitende Verbindung zwischen Elektrolyt-Lösungen. Sie ermöglicht den freien Fluss von Ionen zwischen verbundenen Systemen. Im Falle eines aus zwei Halbzellen bestehenden galvanischen Elementes verhindert die Salzbrücke den Aufbau von Ladung in den Halbzellen, welche den Stromfluss ansonsten frühzeitig zum Erliegen bringen würde. Generell werden Salzbrücken oder ihre Alternativen verwendet, wenn mehrere Systeme zwar miteinander verbunden sein sollen, die freie Diffusion der Teilchen zwischen den Systemen jedoch minimiert werden soll. Der Elektrolyt in Salzbrücken ist eine konzentrierte Salz-Lösung. Bei der Auswahl des Salzes ist zu beachten, dass Anion und Kation möglichst ähnliche Überführungszahlen besitzen (dies ist beispielsweise bei Kaliumchlorid, Kaliumnitrat und Ammoniumnitrat der Fall) und dass es nicht mit den zu verbindenden Elektrolyten reagiert.
Als Salzbrücke dienen in der Regel U-förmige Glasrohre (U-Rohre), die mit der konzentrierten Salz-Lösung gefüllt werden und deren Schenkel in die zu verbindenden Elektrolyt-Lösungen eintauchen. Die Lösung kann verdickt werden (beispielsweise mit Agar), wodurch verhindert wird, dass die Salz-Lösung sich mit den Kontakflüssigkeiten vermischt. Die Leitfähigkeit dieser Art von Salzbrücken nimmt mit steigender Konzentration der Salz-Lösung und mit größerem Durchmesser des U-Rohres zu. Luftblasen in der Salzbrücke verringern die Leitfähigkeit und sind daher zu vermeiden.
Alternativ können auch Filterpapierstreifen verwendet werden, die mit der konzentrierten Salzlösung getränkt sind und deren Enden in die zu verbindenden Elektrolyt-Lösungen eintauchen. Die Leitfähigkeit dieser Art von Salzbrücken nimmt mit steigender Konzentration der Salz-Lösung zu und hängt von den Eigenschaften des Filterpapiers ab.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 28.09. 2025