Calciumhydrid
| Sicherheitshinweise | |||||||
|---|---|---|---|---|---|---|---|
| |||||||
Calciumhydrid ist das Metallhydrid des Calciums.
| Kristallstruktur | |
|---|---|
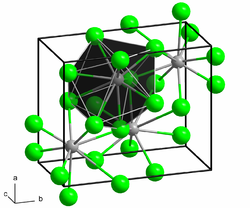
| |
| __ Ca2+ __ H− | |
| Allgemeines | |
| Name | Calciumhydrid |
| Andere Namen |
|
| Verhältnisformel | CaH2 |
| Kurzbeschreibung | farblose hexagonale Prismen |
| Externe Identifikatoren/Datenbanken | |
| CAS-Nummer | 7789-78-8 |
| EG-Nummer | 232-189-2 |
| ECHA-InfoCard | 100.029.263 |
| PubChem | 3033859 |
| Eigenschaften | |
| Molare Masse | 42,1 g/mol−1 |
| Aggregatzustand | fest |
| Dichte | 1,9 g/cm3 |
| Schmelzpunkt | 1000 °C |
| Siedepunkt | Zersetzung > 600 °C |
| Löslichkeit | zersetzt sich in Wasser |
Darstellung
Calciumhydrid wird durch das Überleiten von Wasserstoff über Calcium bei 400 °C hergestellt:
Eigenschaften
Calciumhydrid tritt in zwei polymorphen Kristallformen auf. Die Tieftemperaturform A mit einer orthorhombischen Kristallstruktur wandelt sich bei 780 °C in die Hochtemperaturform B um. Diese schmilzt dann bei 1000 °C.
Verwendung
Da es sich bei Kontakt mit Wasser unter heftiger Wasserstoffentwicklung zersetzt, dient Calciumhydrid als Speichersubstanz, um ortsunabhängig Wasserstoff produzieren zu können:
Je Kilogramm Calciumhydrid entsteht rund 1 m3 Wasserstoff.
Daneben wird Calciumhydrid im so genannten Hydrimet-Verfahren eingesetzt, um Metalloxide (beispielsweise Vanadiumpentoxid, Zirkoniumdioxid, Titandioxid oder Natriumperoxid) zu elementarem Metall zu reduzieren. Mit Verarbeitungstemperaturen zwischen 600 und 1.000 °C geschieht dies bei relativ schonenden Bedingungen. Die sich bei der Reaktion bildende Wasserstoffatmosphäre schützt darüber hinaus das entstehende Metall:
Wegen seiner wasserziehenden Eigenschaft findet Calciumhydrid auch als Trocknungsmittel Anwendung.
Es wird auch dazu genutzt, die Restfeuchte in Kunststoffen zu messen.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 25.03. 2023
