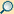Golgi-Apparat
| Übergeordnet |
| Organell |
| Untergeordnet |
| Golgi-Membran Golgi-Lumen Golgi-Stapel Golgi-Netzwerke Golgi-Zisternen Proteinkomplexe |
| Gene Ontology |
|---|
|
|

1. Nucleolus (Kernkörperchen)
2. Zellkern (Nukleus)
3. Ribosomen
4. Vesikel
5. Raues (Granuläres) ER (Ergastoplasma)
6. Golgi-Apparat
7. Cytoskelett
8. Glattes (Agranuläres) ER
9. Mitochondrien
10. Lysosom
11. Cytoplasma (mit Cytosol und Cytoskelett)
12. Peroxisomen
13. Zentriolen
14. Zellmembran

(1) Kernmembran,
(2) Kernpore,
(3) Raues ER,
(4) Glattes ER,
(5) Ribosom auf dem rauen ER,
(6) Transportvesikel mit Proteinen,
(7) Transport-Vesikel,
(8) Golgi-Apparat,
(9) cis-Golgi-Netzwerk,
(10) trans-Golgi-Netzwerk,
(11) Zisternen des Golgi-Apparates.
Der Golgi-Apparat [ˈɡɔld͡ʒi] (das zweite „g“ wird ähnlich wie das „j“ in Jeans ausgesprochen) zählt zu den Organellen eukaryotischer Zellen und bildet einen membranumschlossenen Reaktionsraum innerhalb der Zelle. Er ist an der Sekretbildung und weiteren Aufgaben des Zellstoffwechsels beteiligt und wurde nach dem italienischen >Pathologen Camillo Golgi benannt, der ihn 1898 bei histologischen Forschungen am Gehirn entdeckte und durch seine Färbemethoden zum Fortschritt in der Erforschung des Nervensystems beitrug.
Aufbau
Bei den meisten Eukaryoten ist der Golgi-Apparat in mehreren Abschnitten strukturiert und besteht aus Stapeln von miteinander verschmolzenen, membranumschlossenen, Bläschen, die aus Cytoplasma entstehen und als Zisternen oder Dictyosomen bezeichnet werden. Säugetierzellen enthalten typischerweise 40–100 solcher Stapel. Jeder Stapel besteht dabei aus typischerweise 4–8 Dictyosomen, in einzelnen Protisten wurden bis zu 60 Dictyosomen pro Stapel beobachtet.
Der Golgi-Apparat befindet sich meist nahe dem Zellkern und Zentrosom, was durch Mikrotubuli gewährleistet wird. In manchen Zellen ist der Golgi-Apparat jedoch nicht auf diesen Raum begrenzt, sondern im gesamten Cytoplasma verteilt; dies trifft für die meisten Pflanzenzellen und einige nicht pflanzliche Zellen zu.
Am Golgi-Apparat lässt sich eine eindeutige Polarisierung feststellen. Die Seite, die dem Endoplasmatischen Retikulum (ER) zugewandt ist und abgeschnürte Vesikel von diesem empfängt, welche mit dem Hüllprotein COP II besetzt sind, nennt sich cis-Golgi-Netzwerk (CGN); sie ist konvex. Ebenfalls können Vesikel vom CGN zum ER geschickt werden, hierfür werden die Vesikel mit einem anderen Hüllenprotein (COP I) versehen. Die Seite, die dem ER abgewandt und eher der Plasmamembran zugewandt ist, wird als trans-Golgi-Netzwerk (TGN) bezeichnet; sie ist konkav. Hier werden sogenannte Golgi-Vesikel abgeschnürt. Bei den Golgi-Netzwerken handelt es sich um mehrere kleinere Zisternen und Vesikel, die untereinander in Verbindung stehen.
Die Zisternen zwischen den Golgi-Netzwerken werden Golgi-Stapel genannt, die einzelnen Stapel enthalten eine spezifische enzymatische Ausstattung. Für das Durchlaufen der Proteine durch den Golgi-Apparat gibt es zwei Modelle, die vermutlich beide zutreffend sind: Zum einen „wandern“ die einzelnen Zisternen von der cis- zur trans-Seite, während die Enzyme über entgegengesetzten vesikulären Transport für die nachrückende Zisterne zurückbehalten werden (Modell der Zisternenreifung). Zum anderen beobachtet man Vesikelbewegungen, durch die die Proteine zur nächsten Zisterne – in Richtung des TGN – transportiert werden (Modell des vesikulären Transports); der Golgi-Apparat ist also ein dynamisches System.
Kommt es in der Zelle zur Zellteilung, zerfällt der Golgi-Apparat und wird auf beide Tochterzellen aufgeteilt, wo er sich dann wieder zusammensetzt.

Transmissionselektronenmikroskopische Aufnahme eines kontrastierten Ultradünnschnitts. Schnittebene parallel zur Stapelachse, die abgeflachten, membranbegrenzten Säckchen sind quer geschnitten. Über dem trans-Golgi-Netzwerk befinden sich abgeschnürte Vesikel.
Strukturvielfalt am Beispiel Hefe
In Pichia pastoris gibt es normalerweise ungefähr vier Golgi-Stapel pro Zelle, die aus je vier Zisternen bestehen. Im Gegensatz zu Wirbeltierzellen ist die Struktur der Golgi-Stapel in P. pastoris unabhängig von Mikrotubuli oder dem Zellzyklus. Die Golgi-Stapel wachsen nicht aus der Kernhülle, sondern werden am Endoplasmatischen Retikulum (ER) gebildet. Da P. pastoris gebündelte Strukturen des ER aufweist, entstehen typische Golgi-Stapel direkt daneben. Im Gegensatz dazu besitzt Saccharomyces cerevisiae in der gesamten Zelle verteilt Strukturen des ER, die einen ebenso verstreuten Golgi formen anstatt typische Golgi-Stapel.
Funktionen
Die Funktionen des Golgi-Apparates sind vielfältig und sehr komplex, lassen sich aber nach dem heutigen Wissensstand in drei Gruppen einteilen:
- Bildung und Speicherung sekretorischer Vesikel (extrazelluläre Matrix, Transmitter/Hormone),
- Synthese und Modifizierung von Elementen der Plasmamembran,
- Bildung von primären Lysosomen.
Wie schon oben beschrieben, empfängt der Golgi-Apparat (meist vom ER) Vesikel, in denen Proteine bzw. Polypeptide enthalten sind; diese Proteine werden hier nun weiter modifiziert. Je nach späterer Verwendung und nach Protein werden unterschiedliche weitere Proteine oder Zuckerreste (Glykosylierung) unterschiedlicher Länge an das eigentliche Protein gebunden; auch wird die Struktur des Proteins verändert. All diese Modifizierungen finden innerhalb des Golgi-Apparates statt, da sie im Cytoplasma zu Reaktionen mit anderen Zellorganellen und Stoffen führen würden, was den sofortigen Tod der Zelle bedeuten könnte.
Sind die Proteine vollständig modifiziert, werden sie im TGN nach ihrem Bestimmungsort sortiert, in Golgi-Vesikeln abgeschnürt, mit Signalproteinen versehen (SNARE-Proteine) und über zellinterne Transportmechanismen an den Ort ihrer Bestimmung transportiert. Die meisten Proteine, die im Golgi-Apparat modifiziert werden, werden über Exozytose aus der Zelle heraus transportiert, so kann über Exozytose die extrazelluläre Matrix (EZM) modifiziert werden, wobei wichtig ist, dass alle Substanzen außer dem Glycosaminoglycan (GAG) Hyaluronan (früher: Hyaluronsäure), welches einen bedeutenden Anteil der EZM bildet, im Golgi-Apparat hergestellt werden. Die Modifizierung der EZM trägt maßgeblich zur interzellulären Kommunikation und zur Stabilität der Gewebe bei und ist somit eine der wesentlichsten Aufgaben des Golgi-Apparates. Außerdem kann eine Zelle zum Beispiel ihre Zellmembran ausbessern oder vergrößern; gleichzeitig ist der Zelle eine Möglichkeit gegeben, die äußere Struktur der Membran zu verändern, was dem Stoffwechsel und der interzellulären Kommunikation dienlich sein kann.
Der Golgi-Apparat bildet primäre Lysosomen. Darin enthalten sind lytische Enzyme, deren Aktivitätsoptimum bei einem pH-Wert von ungefähr 4,5 liegt, was bedeutet, dass das Innere des Lysosoms angesäuert werden muss, was durch spezifisch in die Membran eingebaute Protonenpumpen gewährleistet wird. Das Innere des Lysosoms ist als Säureschutz mit Proteoglykanen ausgekleidet. Damit beim Abschnüren von Lysosomen keine falschen Proteine eingeschlossen werden, ist die lysosomale Membran mit Mannose-6-phosphat-Rezeptoren besetzt, an die die lytischen Enzyme, welche mit Mannose-6-phosphaten modifiziert wurden, binden.
Die Funktion des Golgi-Apparates ist in pflanzlichen und tierischen Zellen nahezu identisch, die wichtigste Aufgabe des Golgi-Apparates bei Pflanzen ist jedoch die Produktion von Polysacchariden für die pflanzliche Zellwand (Pektine und Hemizellulosen). Da diese Stoffe in sehr großen Mengen produziert werden müssen, wird hierdurch die enorme Quantität des Golgi-Apparates in der Pflanzenzelle im Vergleich zur tierischen Zelle erklärt.
Postmetapher
Der Golgi-Apparat funktioniert im Grunde wie die Post: Er empfängt Proteinpäckchen aus dem Endoplasmatischen Retikulum. Innerhalb des Golgi werden diese Proteine modifiziert, indem Zuckermonomere entfernt oder ersetzt werden. Zusätzlich werden die Proteine sortiert, indem Identifikationssymbole wie Phosphatgruppen (ähnlich einer Postleitzahl) angehängt werden. Diese „Postleitzahl“ nennt den Zielort. Schließlich werden die Proteine in Transportvesikeln versendet.
Literatur
- Bruce Alberts u.a.: Molecular Biology of the Cell. 5. Auflage. Garland Science, New York 2008, ISBN 0-8153-4106-7.
- Neil A. Campbell u.a.: Biologie. 1. Auflage, 1. korrigierter Nachdruck, Spektrum, Heidelberg 1997, ISBN 3-8274-0032-5.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 21.12. 2024