AIDS
Acquired Immune Deficiency Syndrome, auch Acquired immunodeficiency syndrome (englisch für „erworbenes Immundefektsyndrom“), zumeist abgekürzt AIDS oder Aids, bezeichnet eine spezifische Kombination von Symptomen, die beim Menschen infolge der durch Infektion mit dem Humanen Immundefizienz-Virus (HI-Virus, HIV) induzierten Zerstörung des Immunsystems auftreten. Bei den Erkrankten kommt es zu lebensbedrohlichen opportunistischen Infektionen und Tumoren.
AIDS wurde am 1. Dezember 1981 als eigenständige Krankheit erkannt. Laut UNAIDS lebten im Jahr 2009 weltweit etwa 33 Millionen HIV-positive Menschen. 2009 kam es zu etwa 2,6 Millionen HIV-Neuinfektionen (d.h. etwa 7.000 Neuinfektionen pro Tag), und etwa 1,8 Millionen Menschen starben an den Folgen von HIV/AIDS, darunter etwa 260.000 Kinder unter 15 Jahren. Der Anteil der HIV-Infizierten liegt weltweit durchschnittlich bei etwa 1 % der 15- bis 49-Jährigen, erreicht in einzelnen afrikanischen Staaten jedoch Werte um 20 %. Durch die effektivere Behandlung von HIV-Infizierten mit neuen Medikamenten ist AIDS in Mitteleuropa seltener geworden.

Definition und Klassifikation
Klassifikation in der ICD-10
| Klassifikation nach ICD-10 | ||
|---|---|---|
| B20 | Infektiöse und parasitäre Krankheiten infolge HIV-Krankheit | |
| B20.0 | Mykobakterielle Infektionen infolge HIV-Krankheit (z. B. Tuberkulose infolge HIV-Krankheit) |
|
| B20.1 | Sonstige bakterielle Infektionen infolge HIV-Krankheit | |
| B20.2 | Zytomegalie infolge HIV-Krankheit | |
| B20.3 | Sonstige Virusinfektionen infolge HIV-Krankheit | |
| B20.4 | Kandidose infolge HIV-Krankheit | |
| B20.5 | Sonstige Mykosen infolge HIV-Krankheit | |
| B20.6 | Pneumocystis-Pneumonie infolge HIV-Krankheit | |
| B20.7 | Mehrere Infektionen infolge HIV-Krankheit | |
| B20.8 | Sonstige infektiöse und parasitäre Krankheiten infolge HIV-Krankheit | |
| B20.9 | Nicht näher bezeichnete infektiöse oder parasitäre Krankheit infolge HIV-Krankheit | |
| B21 | Bösartige Neubildungen infolge HIV-Krankheit | |
| B21.0 | Kaposi-Sarkom infolge HIV-Krankheit | |
| B21.1 | Burkitt-Lymphom infolge HIV-Krankheit | |
| B21.2 | Sonstige Typen des Non-Hodgkin-Lymphoms infolge HIV-Krankheit | |
| B21.3 | Sonstige bösartige Neubildungen des lymphatischen, blutbildenden und verwandten Gewebes infolge HIV-Krankheit | |
| B21.7 | Mehrere bösartige Neubildungen infolge HIV-Krankheit | |
| B21.8 | Sonstige bösartige Neubildungen infolge HIV-Krankheit | |
| B21.9 | Nicht näher bezeichnete bösartige Neubildungen infolge HIV-Krankheit | |
| B22 | Sonstige näher bezeichnete Krankheiten infolge HIV-Krankheit | |
| B22.0 | Enzephalopathie infolge HIV-Krankheit | |
| B22.1 | Interstitielle lymphoide Pneumonie infolge HIV-Krankheit | |
| B22.2 | Kachexie-Syndrom infolge HIV-Krankheit | |
| B22.7 | Mehrere anderenorts klassifizierte Krankheiten infolge HIV-Krankheit | |
| B23 | Sonstige Krankheitszustände infolge HIV-Krankheit | |
| B23.0 | Akutes HIV-Infektionssyndrom | |
| B23.1 | (Persistierende) generalisierte Lymphadenopathie infolge HIV-Krankheit | |
| B23.2 | Blut- und Immunanomalien infolge HIV-Krankheit, anderenorts nicht klassifiziert | |
| B23.8 | Sonstige näher bezeichnete Krankheitszustände infolge HIV-Krankheit | |
| B24 | Nicht näher bezeichnete HIV-Krankheit | |
|
| ||
In der ICD-10 können zahlreiche Krankheiten als Folge einer HIV-Infektion codiert werden, beziehungsweise auch die HIV-Infektion ohne Symptome. Die genaue Art der Folgeerkrankung wird in der zuletzt für das Jahr 2013 von der Weltgesundheitsorganisation aktualisierten Version der ICD-10 in einer vierten Stelle verschlüsselt, zum Beispiel: B20.6 Pneumocystis-Pneumonie infolge HIV-Krankheit.
Die ICD wurde ursprünglich geschaffen, um die weltweite Erforschung von Morbidität und Mortalität mit einer international einheitlichen Systematik zu ermöglichen. In vielen Ländern dient die ICD-10 – zum Teil in nationaler Anpassung – zusätzlich als Grundlage für die Vergütung von medizinischen Leistungen.
CDC-Definition
Die international weitestgehend anerkannte Definition von AIDS ist die Klassifikation der Centers for Disease Control and Prevention aus dem Jahr 1993. Sie berücksichtigt klinische Befunde und Laborparameter. Zum einen gibt es eine Stadieneinteilung je nach der Zahl an CD4-(„T-Helfer“-)Zellen/µl:
| Kategorisierung anhand der T-Helferzellzahl | ||
|---|---|---|
| Kategorie | T-Helferzellzahl pro Mikroliter (µl) |
Klinische Bedeutung |
| 1 | ≥ 500 | weitgehend unbeeinträchtigtes Immunsystem |
| 2 | 200 – 499 | leichte bis mittelschwere Immunschwäche |
| 3 | < 200 | schwere Immunschwäche, lebensbedrohliche Infektionen |
Nach CDC-Definition müssen immer ein positiver HIV-Test und ein Bestätigungstest vorliegen.
Zum anderen gibt es die im folgenden ausgeführte klinische Einteilung in Kategorien oder Stadien A bis C.
Kategorie oder Stadium A
Die Kategorie A umfasst die akute (symptomatische) HIV-Infektion, die anhaltende generalisierte Lymphknotenschwellung und die asymptomatische HIV-Infektion.
Kategorie oder Stadium B
Kategorie B wird für alle HIV-assoziierten klinische Symptome, die nicht zu den AIDS-definierenden Erkrankungen gehören, verwendet. Diese sind nicht für die HIV-Infektion spezifisch, treten bei HIV-Infizierten aber häufiger oder in stärkerer Form als bei Nicht-Infizierten auf. Sie zeigen eine Störung der zellvermittelten Immunantwort an. Dabei ist zu beachten, dass es außer der HIV-Infektion auch andere Erkrankungen oder medizinische Konstellationen gibt, die eine schwerwiegende Immunschwäche hervorrufen können (beispielsweise akute und chronische Leukämien, etc.). Das Auftreten einer der u.g. Erkrankungen oder Symptome zeigt primär nur eine Immunschwäche an. Um die Diagnose „AIDS“ zu stellen muss ein positiver HIV-Test hinzukommen, andernfalls muss nach einer anderen Ursache gesucht werden.
Beispiele für Kategorie B-Symptome sind:
- bazilläre Angiomatose
- Candidose (Candidiasis), oropharyngeal (Mundhöhle und Rachen)
- Candidose, vulvovaginal (anhaltend, häufig, oder nicht auf Therapie ansprechend)
- zervikale Dysplasie (moderat oder schwerwiegend) oder Carcinoma in situ der Cervix uteri
- konstitutionelle Symptome wie Fieber (38,5 °C) oder Diarrhöe, die länger als 1 Monat anhalten
- Haarzellleukoplakie, oral
- Herpes zoster („Gürtelrose“), mindestens 2 Episoden oder an unabhängigen Dermatomen
- Idiopathische thrombozytopenische Purpura (ITP)
- Listeriose
- pelvines Inflammationssyndrom, insbesondere verbunden mit tubo-ovariellem Abszess
- periphere Neuropathie
Kategorie oder Stadium C
Die Kategorie C enthält die AIDS-definierenden Erkrankungen. Es handelt sich um opportunistische und maligne Erkrankungen, die bei einem gesunden Immunsystem nicht oder nicht in der vorliegenden Weise auftreten.
AIDS-definierende Erkrankungen (Kategorie C, bei Nachweis einer HIV-Infektion) sind:
- Candidose von Bronchien, Luftröhre oder Lungen
- Candidose, ösophageal (d.h. der Speiseröhre)
- CMV-Infektionen (außer Leber, Milz, Lymphknoten)
- CMV-Retinitis (Netzhautentzündung mit Visusverlust)
- Enzephalopathie, HIV-bedingt
- Herpes-simplex-Infektionen: chronische Ulzera (> ein Monat bestehend; oder Bronchitis, Pneumonie, Ösophagitis)
- Histoplasmose, disseminiert oder extrapulmonal
- Isosporiasis, chronisch, intestinal, mehr als ein Monat bestehend
- Kaposi-Sarkom
- Kokzidioidomykose, disseminiert oder extrapulmonal
- Kryptokokkose, extrapulmonal
- Kryptosporidiose, chronisch, intestinal, > ein Monat bestehend
- Burkitt-Lymphom
- Lymphom, immunoblastisches
- Lymphom, primär zerebral
- „Mycobacterium avium complex“ or M. kansasii, disseminiert oder extrapulmonal
- Mycobakteriose, andere oder nicht identifizierte Spezies disseminiert oder extrapulmonal
- Pneumocystis-Pneumonie
- Pneumonien, bakteriell rezidivierend (> zwei innerhalb eines Jahres)
- Progressive multifokale Leukenzephalopathie
- Salmonellen-Septikämie, rezidivierend
- Tuberkulose
- Toxoplasmose, zerebral
- Wasting-Syndrom
- Zervixkarzinom, invasiv
Eine Rückstufung nach Besserung von Symptomen oder Laborwerten ist in der originalen CDC-Klassifikation nicht vorgesehen, da zum damaligen Zeitpunkt noch keine wirksame „antiretrovirale“ Therapie der HIV-Infektion existierte. Auch werden einige opportunistische Infektionen nicht berücksichtigt, die damals noch nicht als HIV-assoziiert geläufig waren. In Südostasien ist beispielsweise eine Infektion mit Penicillium marneffei bei HIV-Patienten häufig. Auch andere Erkrankungen (Aspergillosen, Mikrosporidiosen, Leishmaniosen, Morbus Hodgkin, …) sind bislang unberücksichtigt. Dagegen sind Histoplasmosen oder Isosporidiosen in Mitteleuropa Raritäten. Ein großes Problem der eng gefassten Definition ist, dass in vielen Ländern der Zugang zu Medikamenten nur mit einer AIDS-Diagnose nach CDC-Klassifikation möglich ist.
Bangui-Definition
| Symptome/Erkrankungen | Punktzahl |
|---|---|
| Wichtige Symptome | |
| ungewollter Gewichtsverlust über 10 % | 4 |
| Asthenie (Kraftlosigkeit) | 4 |
| Häufige Symptome | |
| Fieberhafte Episoden, länger als einen Monat anhaltend | 3 |
| Durchfall, länger als einen Monat anhaltend | 3 |
| Andere Symptome | |
| Husten | 2 |
| Lungenerkrankungen | 2 |
| juckende Dermatitis | 4 |
| ösophageale Candidose | 4 |
| chronische oder generalisierte Herpes-simplex-Infektion | 4 |
| rezidivierender Herpes Zoster | 4 |
| generalisierte Lymphadenopathie | 2 |
| neurologische Symptome | 2 |
| generalisiertes Kaposi-Sarkom | 12 |
| Kryptokokkenmeningitis | 12 |
| Quelle: |
|
Im Gegensatz zur CDC-Definition basierte die afrikanische Bangui-Definition der WHO aus dem Jahr 1985 ausschließlich auf einer klinischen Diagnose, das heißt ohne Hinzuziehung von Laborwerten.
In Afrika ist bis heute ein HIV-Test häufig weder bezahlbar, noch allumfassend durchführbar. In der ersten Fassung der Bangui-Definition wurde der positive HIV-Test als notwendige Bedingung deshalb weggelassen. Stattdessen wurden mehrere nach einem Punktesystem bewertete klinische Symptome herangezogen. Ausschlusskriterien für eine Diagnose nach der Bangui-Definition waren starke Unterernährung, Krebs oder eine immunsuppressive Behandlung. Sobald 12 oder mehr Punkte erreicht waren und kein Ausschlusskriterium vorlag, galt die Diagnose AIDS als gesichert. Für Kinder galt eine leicht angepasste Definition.
Die WHO gab 1994 eine erweiterte AIDS-Definition für Afrika heraus. Es wurde nun empfohlen, einen HIV-Test zu machen. Zusätzlich wurde die Liste der Symptome gekürzt und spezifiziert. Gleichzeitig wurde festgelegt, dass die Bangui-Definition weiterhin gelten soll, wenn ein HIV-Test nicht durchführbar sei.
Übertragung
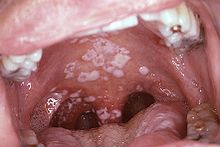
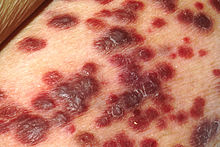
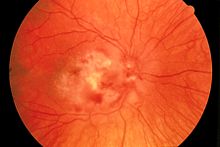
Das HI-Virus wird mit den Körperflüssigkeiten Blut, Sperma, Vaginalsekret, Liquor cerebrospinalis und Muttermilch übertragen. Potentielle Eintrittspforten sind frische, noch blutende Wunden in Schleimhäuten (Bindehaut, Mund-, Nasen-, Vaginal- und Analschleimhaut) bzw. nicht ausreichend verhornte, leicht verletzliche Stellen der Außenhaut (Eichel, Innenseite der Vorhaut). Die häufigsten Infektionswege sind der Vaginal- oder Analverkehr ohne Verwendung von Kondomen, der aufnehmende Oralverkehr (Schleimhautkontakt mit Sperma bzw. Menstruationsblut; bei unverletzter Mundschleimhaut stellt der Kontakt mit Präejakulat oder Vaginalsekret ein vernachlässigbares Infektionsrisiko dar, ebenso der passive Oralverkehr) und die Benutzung kontaminierter Spritzen bei intravenösem Drogenkonsum. Homosexuelle Männer gelten pauschalierend als Risikogruppe, da ihnen eine Nähe zur Szene unterstellt wird, in der es zu häufigem Partnerwechsel und ungeschütztem Analverkehr kommen kann. Wie hoch das Risiko beim Geschlechtsverkehr ist, hängt vor allem von der Viruslast in der Samenflüssigkeit, im Scheidensekret und im Blut ab. Diese ist unmittelbar nach der Infektion, bevor sich Antikörper gebildet haben, besonders hoch, nimmt dann ab und steigt in späten Stadien der Erkrankung wieder an.
Bluttransfusionen bergen ebenfalls das Risiko einer HIV-Infektion, Routineüberwachung der Blutspender – wie sie in Deutschland seit 1985 durchgeführt wird – reduziert dieses jedoch stark. In den Ländern Mitteleuropas ist mittlerweile das Risiko eine HIV-Infektion über eine Transfusion eines Blutproduktes zu erhalten, verschwindend gering.
Das Risiko einer Infektion eines Kindes durch eine HIV-infizierte Mutter während der Schwangerschaft oder während der Geburt wird auf 10 bis 30 % geschätzt. Bei bekannter HIV-Infektion der Mutter kann das Risiko einer Übertragung auf das Kind durch die Gabe antiretroviraler Medikamente und die Geburt durch Kaiserschnitt auf etwa 2 % vermindert werden.
Vor allem in der Anfangszeit der Epidemie infizierten sich viele Intravenös-Drogenabhängige durch die gemeinsame Nutzung von Injektionsnadeln. Auch Ärzte und pflegerisches Personal haben ein gewisses Risiko der Ansteckung bei Nadelstichverletzungen im OP oder nach Punktionen an infizierten Patienten.
Die HIV-Konzentration in Tränen, Schweiß, Speichel und Urin reicht für eine Ansteckung nach heutigem Erkenntnisstand nicht aus. Zudem konnte nach heutigem Kenntnisstand der AIDS-Epidemiologie eine Infektion über Insekten oder Tröpfcheninfektion nicht nachgewiesen werden und gilt deshalb als sehr unwahrscheinlich.
Mittels postexpositioneller Prophylaxe (PEP) kann nach einem Vorfall einer möglichen Infektion entgegengewirkt werden. Die 28 Tage andauernde, medikamentöse PEP bietet nur dann vollständigen Schutz, wenn die Behandlung innerhalb von zwei Stunden nach Exposition begonnen wird und kann bis zu 24 Stunden nach intravenöser, und bis zu 72 Stunden nach anderer Exposition über die Schleimhäute noch immer wirksam sein.
Des Weiteren besteht ein Ansteckungsrisiko (bei Patienten mit AIDS-Vollbild, also bei einer CD4-Konzentration < 200 mlU/ml) mit den typischen opportunistischen Erregern: Viren der Herpes-Gruppe, Candida, Streptokokken, Pneumokokken. Partner von Patienten mit AIDS-Vollbild sollten sich auch über diese Erreger und deren Infektionswege informieren.
Ansteckungswahrscheinlichkeit
Übertragung Mutter/Kind
Die Infektionswahrscheinlichkeit von der unbehandelten Mutter auf das Kind während der natürlichen Geburt wird, je nach Studie, mit etwa 10 % bis 40 % angegeben. Die Wahrscheinlichkeit solch einer vertikalen Transmission während und nach der Geburt lässt sich durch antiretrovirale Therapie der Mutter ab dem 3. Trimester, Kaiserschnitt und Verzicht aufs Stillen auf unter 2 % senken.
| Durchschnittliches geschätztes HIV-Infektionsrisiko | ||||
| Art der Exposition | Infektionsrisiko | |||
|---|---|---|---|---|
| Bluttransfusion mit infizierter Konserve | 90 % | |||
| Beim Geburtsvorgang bei infizierter Mutter | 25 % | |||
| Durch infizierte Nadeln beim Drogenkonsum | 0.67 % | |||
| Nadelstich mit kontaminierter Nadel | 0.30 % | |||
| Analsex* | 0.04–3.0 % | |||
| Analsex ohne Ejakulation* | 0.03 % | |||
| Heterosexueller vaginaler Sex* | 0.05–0.30 % | |||
| Heterosexueller vaginaler Sex ohne Ejakulation* | 0.01–0.38 % | |||
| Oralsex*§ | 0–0.04 % | |||
| Oralsex ohne Ejakulation*§ | 0–0.005 % | |||
| *ohne Kondom-Gebrauch §bezieht sich auf orale Stimulation des Penis |
||||
- Hauptquelle dieses Abschnitts: Leitlinie „Postexpositionelle Prophylaxe der HIV-Infektion“ der Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften(AWMF) (hierbei besteht die Grundlage aus neun Studien: drei amerikanische Studien über Infektionen bei homosexuellen Männern bzw. Männer, die Sex mit Männern haben (MSM), drei Studien aus Afrika aus der heterosexuellen Szene, zwei Wahrscheinlichkeitsstudien und diese Studie).
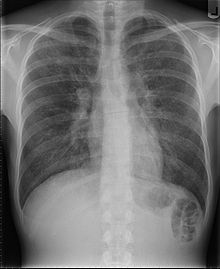
Übertragung durch Bluttransfusionen
In den ersten Jahren nach der Entdeckung von HIV (1981) war die Gefahr der Infektion über kontaminierte Blutprodukte sehr groß. Das hatte die folgenden Gründe: zum einen gab es noch keine zuverlässigen Labor-Tests zu Nachweis des HI-Virus, so dass Blutspender nicht getestet werden konnten. Zum zweiten ist die Gefahr einer Infektion bei Transfusion von infizierten Blutprodukten besonders hoch (viel höher als beispielsweise über Geschlechtsverkehr oder über kontaminierte Nadeln beim intravenösen Drogenkonsum) und zum dritten gab und gibt es Patientengruppen, die regelmäßig Blutprodukte erhalten müssen. Besonders betroffen waren an Hämophilie, der erblichen Bluterkrankheit erkrankte Personen, die regelmäßig Gerinnungsfaktor-Konzentrate transfundiert bekommen mussten. Diese Gerinnungsfaktor-Konzentrate wurden aus Tausenden von Plasmaspenden hergestellt. Dies hatte zur Folge dass bis zum Ende der 1980er Jahre ungefähr 50 % aller etwa 15.000 Hämophilie-Kranken in den USA mit HIV infiziert wurden. Auch in Deutschland wurden etwa 1.800 der ungefähr 3.000 Hämophilie-Kranken und weitere 460 Personen durch Blutprodukt-Transfusionen infiziert, obwohl es bereits damals die (allerdings sehr teure) Möglichkeit einer Virusinaktivierung der Plasmapräparate gab. Der sich daraufhin in der deutschen Öffentlichkeit entwickelnde „Blut-Skandal“ führte 1994 letztlich zur Auflösung des Bundesgesundheitsamtes, das als Aufsichtsbehörde für die Sicherheit von Blutprodukten zuständig gewesen war, durch den damaligen Bundesgesundheitsminister Horst Seehofer. Bedingt durch die Skandale um mit HIV oder Hepatitis-C-Virus infizierte Blutprodukte wurde das Bluttransfusionswesen in Deutschland und anderen Ländern einer rigorosen und strengen gesetzlichen Kontrolle unterworfen. Seit 1985 ist in den USA und Deutschland die Testung aller Blutprodukte auf HIV-Antikörper gesetzlich vorgeschrieben, wodurch sich das Infektionsrisiko auf deutlich weniger als 1:100.000 verminderte (fast alle transfusionsbedingten Infektionen waren vor 1985 erfolgt). Allerdings verblieb noch ein kleines Restrisiko, da erst einige Wochen nach Virusinfektion Antikörper nachweisbar sind. Ganz frische Infektionen können mit einem reinen Antikörpertest nicht erkannt werden. Seit dem 1. Mai 2004 ist in Deutschland auch die Testung jeder Blutspende auf das Vorhandensein von HIV-RNA, also die Virus-Nukleinsäure gesetzlich vorgeschrieben wodurch auch ganz frische Infektionen erkannt werden können und die „diagnostische Lücke“ einer HIV-Infektion weiter verkleinert wurde. Das Risiko, eine HIV-Infektion über ein infiziertes Blutprodukt zu erwerben wird heute in Deutschland auf etwa 1:3 Millionen oder noch deutlich geringer geschätzt.
Übertragung durch Nadeln/Kanülen/Nadelstiche
Das Infektionsrisiko durch Nadelstiche hängt sehr von der Situation ab. Das Infektionsrisiko wird durchschnittlich mit 0,3 % angegeben und steigt mit folgenden Faktoren: sehr tiefe Verletzungen (16-fach erhöht), sichtbare Blutspuren auf der Nadel oder Nadel war vorher in einer Vene oder Arterie des Überträgers (jeweils fünffach erhöht), bei hoher Viruslast des Überträgers (sechsfach erhöht). Das Risiko bei Hohlnadeln ist höher als bei geschlossenen Nadeln.
Das Risiko, sich bei gemeinsamer Benutzung einer Kanüle, meist beim Spritzen von Heroin, zu infizieren, liegt um 0,7 % und sinkt mit dem zeitlichen Abstand zwischen den Injektionen, allerdings nur langsam, da in der Kanüle eingeschlossene Viren lange infektiös bleiben können, teilweise auch noch nach Tagen. Ein Auskochen der Nadeln ist zwar generell möglich, wenn es lange genug durchgeführt wird, allerdings sind handelsübliche Nadeln nicht dafür geeignet, weil die verwendeten Kunststoffe nicht entsprechend hitzefest sind. Eine chemische Desinfektion (Alkohol oder andere Desinfektionsmittel) ist nicht ausreichend, weil nicht gewährleistet ist, dass die Substanzen ganz in die Kanüle eindringen.
Übertragung durch Geschlechtsverkehr
Das individuelle Risiko einer Infektion mit HIV durch Geschlechtsverkehr ist sehr variabel und hängt von vielen Faktoren ab. Eine Infektion ist nach einmaligem Geschlechtsverkehr möglich, es sind jedoch auch Fälle bekannt, in denen trotz mehrjährigen Sexualkontaktes mit einem infizierten Partner keine Ansteckung erfolgte. Eine gleichzeitig vorliegende andere Geschlechtserkrankung erhöht das Infektionsrisiko um das 5- bis 10-fache, eine hohe Viruslast des Überträgers sogar um das 10- bis 30-Fache. Frischinfizierte weisen eine hohe Viruslast auf, da der Körper in diesem Stadium über keine spezifischen Antikörper verfügt. Geschlechtsverkehr während der Regelblutung der Frau ist mit einem erhöhten Infektionsrisiko für beide Partner verbunden, beschnittene Männer haben ein geringeres Infektionsrisiko. Insgesamt scheint das Infektionsrisiko nicht konstant über die Anzahl der Kontakte zu sein, so dass das Risiko einzelner Kontakte womöglich erheblich zu niedrig angegeben ist. Mit besseren Medikamenten sinkt das Übertragungsrisiko durch die sinkende Viruslast in Blut und Sekreten.
- Vaginalverkehr: Ungeschützter vaginaler Geschlechtsverkehr ist mit hohem Risiko behaftet.
- Bei Analverkehr treten häufig kleine Risse an der Schleimhaut auf, daher ist das Risiko im Vergleich zum Vaginalverkehr nochmals signifikant erhöht.
- Fellatio, Oralverkehr mit Spermaaufnahme durch den Mund: Das Infektionsrisiko ist sehr gering, eine Infektion ist jedoch nicht ausgeschlossen.
- Eine Infektion durch Vorflüssigkeit (Präejakulat) ist eher unwahrscheinlich.
- Cunnilingus, Oralverkehr bei der Frau: Das Risiko wird ebenfalls äußerst gering eingeschätzt, solange kein Kontakt mit Menstruationsblut stattfindet.
- Anilingus: Das Risiko wird als äußerst gering eingeschätzt.
- Andere Sexualpraktiken, bei denen kein Kontakt zu Schleimhäuten, Blut, Sperma oder Vaginalsekret besteht, haben ein extrem geringes Infektionsrisiko.
Postexpositionelle Prophylaxe
Teilweise besteht die Möglichkeit einer Postexpositionsprophylaxe. Diese besteht aus allgemeinen Maßnahmen (Waschen des Penis nach dem Verkehr, Ausdrücken der Stichwunden und Behandlung mit Desinfektionsmittel) und spezifischen Maßnahmen wie der Gabe von antiretroviralen Medikamenten.
Nach einem Ansteckungsverdacht sollte immer sofort ein Arzt aufgesucht werden, der über mögliche Maßnahmen informiert und diese auch einleiten kann. Im Idealfall sollte mit der Postexpositionsprophylaxe innerhalb von zwei Stunden nach der Risikosituation begonnen werden. Die Medikation entspricht im Wesentlichen der antiretroviralen Tritherapie eines HIV-positiven Patienten.
HIV-Tests
HIV-Tests unterteilen sich in Suchtests und Bestätigungstests. Ziel eines Suchtests (zum Beispiel ELISA-Suchtest) ist es, möglichst alle infizierten Personen zu erkennen – um den Preis, dass auch einige nicht-infizierte fälschlicherweise positiv getestet werden. Wird eine Person im Suchtest positiv getestet, so ist in vielen Ländern ein Bestätigungstest (in Deutschland und den USA: Western-Blot-Bestätigungstest) vorgeschrieben, um eine falsch positive Diagnose zu verhindern. HIV-Tests werden meist in einem Labor durchgeführt. Es existieren jedoch auch Schnelltests, die ohne technische Hilfsmittel teilweise bereits nach fünf Minuten ein Ergebnis anzeigen können.
Ein HIV-Test darf nur mit ausdrücklicher Zustimmung des Betroffenen durchgeführt werden, eine Testung ohne Wissen des Patienten ist rechtlich unzulässig und kann dementsprechend geahndet werden. In Deutschland muss ein positiver HIV-Test gemäß Infektionsschutzgesetz in anonymisierter Form an das Robert Koch-Institut in Berlin gemeldet werden. In Österreich ist nur die AIDS-Erkrankung, nicht aber die bloße HIV-Infektion meldepflichtig.
Krankheitsverlauf
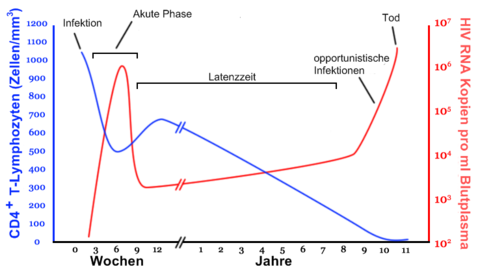
Eine HIV-Infektion verläuft in vier Phasen:
Akute Phase
Zwei bis sechs Wochen nach einer Infektion können grippeähnliche Symptome wie Fieber, Nachtschweiß, geschwollene Lymphknoten, Übelkeit usw. auftreten.
Die häufigsten Symptome einer akuten HIV-Infektion sind (angegeben nach der Wahrscheinlichkeit des Auftretens)
- 80 % Fieber
- 78 % Abgeschlagenheit, Müdigkeit
- 68 % Unwohlsein, Krankheitsgefühl
- 54 % Kopfschmerzen
- 54 % Appetitverlust
- 54 % Arthralgien (Gelenkschmerzen)
- 51 % Hautausschlag
- 51 % Nachtschweiß
- 49 % Myalgien (Muskelschmerzen)
- 49 % Übelkeit
- 46 % Diarrhoe (Durchfall)
- 46 % Fieber und Ausschlag (als Kombination)
- 44 % Pharyngitis oder Schluckschmerzen
- 37 % orale Ulzerationen (Geschwüre im Mund)
- 34 % Steifer Nacken (vermutlich aufgrund der auch dort befindlichen und angeschwollenen Lymphknoten)
- 32 % Gewichtsverlust größer als 2,5 kg
- 24 % Lichtscheu
Manche Patienten bemerken obige Symptome jedoch nicht oder sie haben keine.
Zur Diagnostik einer akuten HIV-Infektion dient ein positiver HIV-RNA-Test durch eine Reverse Transkriptase-Polymerase-Kettenreaktion (RT-PCR) und ein negativer oder „grenzwertiger“ Bestätigungstest.
Latenzphase
In dieser Zeit vermehrt sich das Virus im Körper. Betroffene, sofern sie von ihrer Infektion wissen, leiden allenfalls psychisch darunter, körperliche Symptome treten hingegen keine auf. Die Latenzzeit dauert im Durchschnitt neun bis elf Jahre. Es gibt sowohl Patienten, die innerhalb von Monaten nach der Ansteckung AIDS entwickeln, als auch solche, bei denen trotz Ansteckung in den 80er Jahren und ohne Hochaktive antiretrovirale Therapie (HAART) bis heute keine Progression zu AIDS festzustellen ist.
AIDS Related Complex (ARC)
Dieser Ausdruck wurde früher für das klinische Stadium B der CDC-Klassifikation (also das Auftreten von klinischen Symptomen, die aber nicht zu den AIDS-definierenden Erkrankungen gehören) verwendet. Unbehandelt folgt der Übergang in das Vollbild AIDS.
Krankheitsphase
Die Diagnose AIDS wird gestellt, wenn bei einem HIV-Positiven bestimmte Infektionen oder bösartige Tumoren, die sogenannten AIDS definierenden Erkrankungen, festgestellt werden. Die Infektionen werden als opportunistische Infektionen bezeichnet. Für das (intakte) Immunsystem eines gesunden Menschen sind sie oft harmlos. Durch das kompromittierte Immunsystem eines HIV-Positiven kann sich der Organismus jedoch nicht ausreichend wehren; es treten die oben genannten Infektionen auf. Als Maß für die Zerstörung des Immunsystems dient die T-Helfer-Zellen-Zahl im Blut eines HIV-Infizierten. Unter der Schwelle von 200–400 / µl Blut ist die Therapie indiziert. Im späten Stadium kann sich eine subkortikale Demenz entwickeln.
Therapie
Highly Active Antiretroviral Therapy (HAART)
Mit Highly active antiretroviral therapy (HAART) wird die medikamentöse Kombinationstherapie aus mindestens drei antiretroviralen Wirkstoffen bezeichnet. Ziel von HAART ist, den Ausbruch des Krankheitsbildes AIDS hinauszuzögern. Eine erfolgreiche HAART drückt die Viruslast (Konzentration des HI-Virus im Blut) unter die Nachweisgrenze, woraufhin die CD4-Zellwerte wieder ansteigen und damit das Immunsystem gegen opportunistische Infektionen und andere AIDS-definierende Erkrankungen gestärkt wird. Es ist nicht möglich, das HI-Virus durch HAART aus dem Körper zu eliminieren.
Aufgrund neuer medizinischer Studienergebnisse sowie der Entwicklung und Zulassung neuer antiretroviraler Arzneistoffe und Substanzklassen befindet sich HAART in einem kontinuierlichen Entwicklungsprozess. Dennoch gibt es eindeutige Leitlinien auf nationaler, europäischer und internationaler Ebene zu den verschiedenen Aspekten der antiretroviralen Therapie.
Startzeitpunkt einer HAART
Die Kriterien für den besten Startzeitpunkt einer HAART sind in den jeweiligen nationalen Leitlinien definiert. Diese wägen die Gefahr, an AIDS zu erkranken, gegen die Risiken der Langzeittoxizität und Resistenzbildung ab. Während Mitte der 1990er Jahre die Mutationsgeschwindigkeit des Virus und die Annahme einer möglichen Eradikation zu einer „Hit hard and early!“-Strategie bei der Behandlung verleiteten, führte die Entdeckung mitochondrialer Toxizität zur Zurückhaltung. Heute beginnt eine HAART erst bei deutlicher Schwächung des Immunsystems.
Die Europäische Empfehlung zum Therapiebeginn berücksichtigt drei Faktoren: das klinische Bild des Patienten, seinen CD4-Wert und die Viruslast.
Patienten, die bereits AIDS-definierende Erkrankungen haben (CDC C), wird eine HAART dringend empfohlen. Auch beim Auftreten von Erkrankungen, die auf ein geschwächtes Immunsystem hindeuten, jedoch nicht AIDS-definierend sind (CDC B), wird eine HAART empfohlen. Dies gilt auch für Patienten, die symptomfrei sind, aber einen CD4+-Wert unter 200 haben, da es dann meist eine Frage der Zeit ist, bis AIDS auftritt. Als im Allgemeinen ratsam wird eine Therapie bei Patienten angesehen, die einen CD4+-Wert zwischen 200 und 350 haben. Ebenso angeraten ist der Beginn der HAART laut der Empfehlung bei Patienten mit einem CD4+-Wert zwischen 350 und 500, wenn eine hohe Viruslast vorliegt (> 100.000).
Aufgrund der für den Patienten weitreichenden Konsequenzen wird die Entscheidung individuell getroffen, so dass der Patient zuvor über Risiken und Nebenwirkungen ausreichend informiert und psychisch auf diese Therapie eingestellt ist.
Durch eine antiretrovirale Therapie (ART), das heißt die Einnahme von HIV-unterdrückenden Medikamenten, und Behandlung von Sekundärinfektionen kann der Krankheitsverlauf verlangsamt werden. Da das Virus schnell Resistenzen gegen einzelne Medikamente entwickelt, hat sich die Therapie durch gleichzeitige Einnahme mehrerer Medikamente durchgesetzt, die so genannte „Highly Active Antiretroviral Treatment“ (HAART).
Antiretrovirale Therapie kann die Lebenserwartung HIV-Infizierter deutlich verlängern, jedoch keine vollständige Eradikation des Virus – und damit eine Heilung – bewirken. Zudem können schwerwiegende Nebenwirkungen auftreten. Eine einmal begonnene ART sollte nicht mehr abgesetzt werden, um Resistenzbildung zu verhindern. Aus demselben Grund ist eine regelmäßige Tabletteneinnahme unumgänglich. Daraus ergibt sich eine hohe Belastung für den Patienten.
Zurzeit werden drei Wirkstoffklassen angewandt: Nukleosid- und Nukleotidanaloga (NRTI), Nichtnukleosidische Reverse-Transkriptase-Inhibitoren (NNRTI) und HIV-Proteaseinhibitoren (PI). Eine weitere Wirkstoffklasse stellen Fusionsinhibitoren wie die Substanz T-20 dar.
Wirkstoffe
Nukleosidische Reverse-Transkriptase-Inhibitoren (NRTI)
Nukleosid-Analoga, auch nukleosidische Reverse-Transkriptase-Inhibitoren (NRTI, umgangssprachlich „Nukes“) genannt, setzen an der reversen Transkriptase an, einem Enzym des HI-Virus, das das virale RNA-Genom in doppelsträngige DNA „übersetzt“. Anschließend baut ein weiteres virales Enzym, die Integrase, diese Virus-DNA in die DNA der Wirtszelle ein. Die NRTI stellen hierbei ein alternatives Substrat dar und konkurrieren mit den physiologischen Nukleosiden, unterscheiden sich von diesen jedoch durch ein verändertes Zuckermolekül. Der Einbau der NRTI behindert die Struktur der Doppelstrangbindung und führt daher zu Kettenabbrüchen in der Virus-DNA.
Hierbei entsprechen die Wirkstoffe Zidovudin (Azidothymidin, AZT) und Stavudin (d4T) dem DNA-Baustein Thymidin, Lamivudin (3TC) dem Cytidin, während Didanosin (DDI) analog zu Inosin und Abacavir ein Guanosin-Anologon ist. Eine Kombination von Analoga mit gleichem Ansatzpunkt (etwa AZT und d4T) ist nicht sinnvoll.
Zahlreiche Nebenwirkungen können bei der Therapie mit NRTI auftreten. Häufig sind Kopfschmerzen, gastrointestinale Beschwerden, Völlegefühl oder Übelkeit, Erbrechen und Diarrhoeen sowie allgemeine Müdigkeit. Als Folge längerer Anwendung kann es zur Laktatazidose (Ansammlung von Milchsäure im Blut), Myelotoxizität (Knochenmarksschädigung), Schädigung peripherer Nerven und Bauchspeicheldrüsenentzündungen kommen. Auch eine Lipodystrophie, eine auch bei Therapie mit HIV-Proteaseinhibitoren zu beobachtende Umlagerung von Körperfett, kann bei längerer Einnahme von NRTI auftreten.
Viele dieser Nebenwirkungen sind eine Folge der mitochondrialen Toxizität: Mitochondrien, die lebenswichtigen Kraftwerke der Zellen, benötigen ebenfalls Nukleoside. Durch den Einbau von NRTI statt Nukleosiden kommt es zu Stoffwechselstörungen und zur Degeneration der Mitochondrien. Bei der Toxizität der einzelnen Substrate gibt es erhebliche Unterschiede.
NRTI werden unverändert in die Zelle aufgenommen und dort durch Phosphorylierung aktiviert. Sie werden überwiegend über die Niere (renal) eliminiert und haben daher wenig Wechselwirkung mit Medikamenten, die in der Leber verstoffwechselt werden.
Nicht-nukleosidische Reverse-Transkriptase-Inhibitoren (NNRTI)
Während NRTIs als „falsche“ Bausteine die reverse Transkriptase hemmen, binden nicht-nukleosidische Reverse-Transkriptase-Inhibitoren (NNRTI) direkt an dieses Enzym, nahe der Substratbindungsstelle für Nukleoside. Zurzeit gibt es drei NNRTIs auf dem Markt: Nevirapin, Delavirdin und Efavirenz. Während Nevirapin und Efavirenz etwa gleich effektiv sind, spielt Delavirdin in der Therapie kaum eine Rolle und ist in Deutschland (noch) nicht zugelassen.
Als Einzelsubstanz zeigen NNRTIs nur eine begrenzte Wirkung, in Kombinationstherapie mit zwei NRTIs sind sie aus immunologisch-virologischer Sicht mit HIV-Proteaseinhibitoren gleichwertig. Bisher konnte keine Studie nachweisen, dass die Überlebenszeit verbessert wurde und die Krankheit langsamer fortschreitet als mit HAART. Jedoch wurde eine Verbesserung der Lebensqualität beschrieben. Zur Zulassung wurden ausschließlich Studien zu verbesserten CD4+-Zellzahlen und zur niedrigeren Viruslast benutzt (Surrogat-Marker-Studien). Durch ihre gute Verträglichkeit und die geringere Pillenzahl werden sie häufig den HIV-Proteaseinhibitoren vorgezogen. NNRTIs sind recht empfindlich: Schon eine Punktmutation genügt, um eine Resistenz des Virus gegen den Wirkstoff zu erzeugen. Zudem bestehen Kreuzresistenzen: Zeigt ein Virus Resistenzen gegen einen NNRTI, so sind meist alle NNRTIs wirkungslos. NNRTIs werden in der Leber verstoffwechselt (Cytochrom P450-System).
Die Nebenwirkungsprofile der einzelnen Wirkstoffe unterscheiden sich erheblich. Bei der Therapie mit Nevirapin stehen vor allem allergische Reaktionen und Lebertoxizität im Vordergrund. Ein Ausschlag tritt bei bis zu 20 % der Patienten auf und führt bei 7 % zum Abbruch der Nevirapineinnahme. Um die Gefahr von Allergien zu mindern, wird Nevirapin zu Beginn der Therapie in niedriger Dosierung gegeben. Anschließend wird die Dosis schrittweise erhöht. Lebertoxizität ist eine seltene, aber unter Umständen lebensbedrohliche Nebenwirkung von Nevirapin. Daher sollten zu Beginn der Therapie die Leberwerte (vor allem die Transaminasen) engmaschig kontrolliert werden.
Die Nebenwirkungen von Efavirenz betreffen hingegen vor allem das zentrale Nervensystem. Sie treten meist zu Beginn der Therapie auf und schwächen sich danach ab. Während der ersten vier Wochen einer Studie traten bei zwei Dritteln der Patienten Schwindel, bei nahezu der Hälfte Albträume und bei etwa einem Drittel der Patienten Benommenheit und Schlafstörungen auf. Diese nahmen aber meist nach einiger Zeit ab. Während Nevirapin zur Vorbeugung gegen eine Mutter-zu-Kind-Übertragung (PMTCT = Prevention of Mother to Child Transmission) eingesetzt wird, ist Efivarenz in der Schwangerschaft kontraindiziert. Angesichts der Wirkung auf das zentrale Nervensystem ist die Verkehrstauglichkeit fraglich. Ein Vorteil von Efavirenz gegenüber Nevirapin ist die geringere Lebertoxizität.
Delavirdin ist wegen der hohen Pillenzahl und der dreimal täglichen Einnahme den anderen Wirkstoffen unterlegen. Zudem ist es zurzeit nicht auf dem deutschen Markt zugelassen.
HIV-Proteaseinhibitoren (PI)
Kann das HIV-Enzym HIV-Protease das virale Makromolekül gag-pol-Polyprotein nicht spalten, so werden nicht-infektiöse Viruspartikel produziert. HIV-Proteaseinhibitoren wurden mit dem Wissen über die molekulare Struktur des Enzyms so modelliert, dass sie direkt im aktiven Zentrum der Protease binden können. Die gute Wirksamkeit von HIV-Proteaseinhibitoren wurde anhand von klinischen Endpunkten nachgewiesen. Sie haben zu einer deutlichen Verbesserung der Therapie beigetragen. Bei der Langzeitbehandlung zeigen sich jedoch einige Probleme, die zu Störungen im Fettstoffwechsel führen und in der Folge Lipodystrophie (Fettverteilungsstörungen) und Dyslipidämie (erhöhte Blutfettwerte) auslösen können. Der Grund liegt wahrscheinlich in der mitochondrialen Toxizität, da HIV-Proteaseinhibitoren offenbar ähnlich den NRTI die Mitochondrien schädigen. Weitere Nebenwirkungen sind gastrointestinale Beschwerden.
HIV-Proteaseinhibitoren haben relativ kurze Plasmahalbwertszeiten. Schon nach acht Stunden ist die minimale Hemmkonzentration erreicht. Daher müssen die meisten HIV-Proteaseinhibitoren dreimal täglich eingenommen werden.
Der Abbau der HIV-Proteaseinhibitoren geschieht in der Leber durch das Cytochrom-P450-Enzymsystem. Der HIV-Proteaseinhibitor Ritonavir hemmt dieses System. Man ging daher dazu über, andere Proteaseinhibitoren zusammen mit Ritonavir zu verabreichen, um den Abbau zu verlangsamen und die Plasmahalbwertszeit zu verlängern. Dies wird als „Booster“ bezeichnet. Mittlerweile gibt es den HIV-Proteaseinhibitor Lopinavir kombiniert mit einer Boosterdosis Ritonavir (Kaletra). Dies führt zu einer fast 100-fach größeren Plasma-Konzentration von Lopinavir und zu einer größeren Barriere gegen Resistenzen. Daher wird Lopinavir/Ritonavir (Kaletra) zumeist nach Therapieversagen anderer Medikamente benutzt („Salvage-Bereich“).
Ein weiteres Problem ist die Wechselwirkung von HIV-Proteaseinhibitoren mit vielen anderen Substanzen: zum einen über das Cytochrom-P450-Enzymsystem mit Inhaltsstoffen der Grapefruit, zum anderen besteht eine gegenseitige Wechselwirkung (sowohl gegenseitige Abschwächung als auch gegenseitige Verstärkung) zu Östrogen, was den gleichzeitigen Einsatz von HIV-Proteasehemmern und hormonellen Kontrazeptiva verhindert.
Entry-Inhibitoren
Entry-Inhibitoren unterbrechen den Eintritt des Virus in die Wirtszelle.
Fusions-Inhibitoren (FI)
Anfang 2003 wurde der erste Fusionsinhibitor Enfuvirtid (entwickelt unter der Bezeichnung T-20) auf den Markt gebracht. T-20 bindet an das für die Fusion des Virus mit der Zellmembran der T-Helferzellen wichtige Transmembranprotein gp41 und blockiert so den Eintritt des Virus in die Zelle. Besonders interessant wird die Substanz dadurch, dass sie keine mitochondriale Toxizität und damit kein Lipodystrophiesyndrom auslöst.
T-20 ist mit seinen 36 Aminosäuren zu groß für eine orale Einnahme. In seiner jetzigen Form muss T-20 täglich subkutan gespritzt oder über eine Infusionspumpe verabreicht werden. Als Nebenwirkung treten häufig Hautirritationen an der Einstichstelle auf.
Erste Studien ergaben, dass eine bloße Hinzugabe von T-20 zu einer klassischen antiretroviralen Therapie nur einen begrenzten Erfolg mit sich bringt. Zwei große Studien, die T-20 zu einer optimierten HAART gegen eine optimierte HAART ohne T-20 verglichen, zeigte jedoch signifikant bessere Werte im T-20-Arm der Studie. Das lässt darauf schließen, dass besonders diejenigen Patienten von T-20 profitieren, die gleichzeitig auch noch andere medikamentöse Optionen haben.
T-20 kann offenbar zu Interaktionen mit Granulozyten führen, die bei einigen Patienten zu vermehrten Infektionen führten.
Eine rasche Resistenzbildung des Virus ist zudem recht wahrscheinlich. Jedoch scheint die virale Angepasstheit an den menschlichen Wirt der resistenten Stämme vermindert zu sein.
Dennoch gibt T-20 den Patienten, die auf Grund von Nebenwirkungen oder Resistenzen ihre Therapie umstellen müssen, eine Option. Erste Wahl zu Therapiebeginn ist T-20 derzeit jedoch nicht, und das nicht nur auf Grund der Studienlage. T-20 ist nach Aussage der Herstellerfirma F. Hoffmann-La Roche AG eine der am aufwändigsten zu produzierenden Substanzen der Firmengeschichte. Dies spiegelt sich im Preis wider, der mit über 24.000 Euro pro Jahr höher als einige Dreifachkombinationen herkömmlicher antiretroviraler Medikamente liegt.
Weiterhin gibt es seit Frühjahr 2007 Maraviroc (MVC) im Expanded-Access-Programm zur Letztbehandlung von HIV-Patienten, die sonst keine Therapieoption mehr haben.
An anderen Fusionsinhibitoren und an einer wöchentlich zu verabreichenden T-20-Injektion wird geforscht.
Integrase-Inhibitoren
Nach vielen Fehlschlägen und Schwierigkeiten in den 1990ern begann ab 2000 die Entwicklung der Integrase-Inhibitoren an Fahrt aufzunehmen. Damals wurde das Prinzip der Strangtransfer-Inhibition aufgedeckt. Seit 2005 geht es nun auch in klinischen Studien rasant voran, spätestens nach den ersten Daten der Phase-III-Studien zu Raltegravir (MK-0518) sind die Integrasehemmer die nächste neue Substanzgruppe in der HIV-Therapie. MK-0518 ist mittlerweile im Expanded-Access-Programm, also zur Letztbehandlung von HIV-Patienten, die sonst keine Therapieoption mehr haben, zugelassen.
Vorbeugung

Prävention ist die effektivste Maßnahme gegen HIV. Durch den Gebrauch von Kondomen, sterilen Nadeln bei der Einnahme von Drogen und bei Impfungen sowie Blutspenden kann man einer Infektion sehr sicher entgehen. Die UNESCO hat 2004 mit EDUCAIDS ein weltweites Programm zur Aufklärung der Bevölkerung gestartet. Nach einem Ereignis mit Ansteckungsrisiko kann die Wahrscheinlichkeit einer Infektion vermindert werden, wenn eine so genannte Postexpositionsprophylaxe durchgeführt wird.
Eine HIV-Impfung existiert nicht. An der hohen Mutationsrate des HI-Virus scheiterten bisher die langjährigen Forschungen um Impfstoffe, die die Bildung von schützenden Antikörpern gegen das Oberflächenprotein gp120 fördern sollten. Als das Mittel gegen das sehr ähnliche SIV (SI-Virus, simian Immunodeficiency virus) der Affen erfolgreich getestet worden war, hatte das HI-Virus in freier Wildbahn die Struktur seines gp120 Oberflächenproteins verändert.
Epidemiologie
Die Prävalenzratio beträgt weltweit 0,0059, in Deutschland 0,0007, in Österreich 0,0011 (Stand 2006).
Allgemein
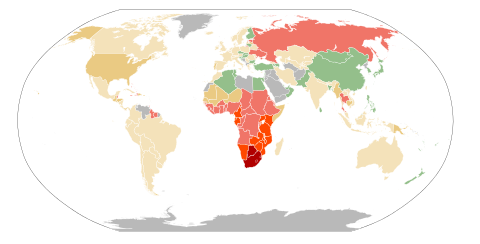
- keine Daten verfügbar
- unter 0,1 %
- 0,1–0,5 %
- 0,5–1 %
- 1–5 %
- 5–15 %
- 15–50 %
Aus epidemiologischer Sicht ist das weltweite Verteilungsmuster von HIV interessant: Während sich die meisten Viren gleichmäßig schnell ausbreiten, war dies bei HIV anders.
Der erste entdeckte AIDS-Erreger ist ein HI-Virus 1 vom Subtyp B aus der Hauptgruppe M. Dieses Virus tauchte erstmals um 1930 in Zentralafrika auf. Ein internationales Forscherteam kommt nach Gen-Analysen zahlreicher HIV-Subtypen aus aller Welt zu dem Schluss, dass dieses Virus um das Jahr 1966 herum von Afrika nach Haiti gelangte. Die Untersuchungen belegen ferner, dass sich das Virus mit hoher Wahrscheinlichkeit zunächst innerhalb von Haiti und dann von dort über die ganze Welt ausbreitete. So erreichte es von Haiti aus 1969 die USA. Zu diesem Schluss gelangten Forscher um Michael Worobey an der Universität Arizona nach der eingehenden Analyse von Virusproben der ersten bekannten AIDS-Patienten aus Haiti. In den USA habe sich das Virus zunächst sehr langsam in der heterosexuellen Bevölkerung ausgebreitet, bevor es sich dann wenig später innerhalb der Hochrisiko-Gruppe homosexueller Männer stärker verbreitete.
Während die HIV-Epidemie in den USA bereits in den 1980er Jahren begann, gab es einige Länder, die von HIV verschont zu sein schienen, dann aber mit großer Geschwindigkeit vom Virus erobert wurden. So geschah es vor allem in Osteuropa und Asien Mitte der 1990er Jahre. In anderen Ländern, zum Beispiel Kamerun, blieb die Prävalenz von HIV jahrelang stabil, um dann sprunghaft anzusteigen. Auch eine Obergrenze in der HIV-Prävalenz scheint es nicht zu geben. So stieg die Quote der schwangeren Frauen mit HIV in städtischen Zentren in Botswana nach 1997 in vier Jahren von 38,5 auf 55,6 %.
Eine nachhaltig erfolgreiche Bekämpfung von HIV/AIDS in afrikanischen Hochprävalenzländern muss die Reduktion sowohl von AIDS-bedingten Todesfällen als auch von Neuinfektionen umfassen. Daten aus einigen schwer von der HIV-Epidemie getroffenen Ländern wie Kenia, Ruanda, Uganda und Simbabwe zeigen, dass sich die Rate der Neuinfektionen durch Änderungen im Sexualverhalten verringern lässt. Als Grundlagen dieses Erfolges gelten die landesweite Einführung von Sexualkundeunterricht, die zunehmende Einführung der antiretroviralen Therapie, flächendeckende Kampagnen zur Steigerung der Akzeptanz von Kondomen, HIV-Tests, deren Ergebnisse noch am selben Tag bekannt gegeben wurden, und Selbsthilfe-Kits für sexuell übertragbare Krankheiten. Diese Erfolge sind jedoch nur mit finanziellen Mitteln durchführbar, die viele der Hochendemie-Länder in Afrika nicht allein aufbringen können. Unabdingbar ist ferner ebenso ein politischer Wille, diese Seuche aktiv zu bekämpfen. Laut Daten aus Uganda konnte die Prävalenz von HIV bei schwangeren Frauen von fast 30 % im Jahr 1992 auf 5,4 % im Jahr 2007 gesenkt werden. Das Erfolgsmodell Uganda ist nicht unumstritten: Zur Reduktion der HIV-Prävalenz haben auch eine verbesserte Datenerhebung und die dramatische Sterblichkeitsrate von Menschen mit HIV/AIDS beigetragen. In Simbabwe ging die Prävalenz von 29 % (1997) auf 16 % (2007) zurück. Eine interdisziplinäre UNAIDS-Studie kam zum Schluss, dass der hauptsächliche kausale Faktor eine Änderung des Sexualverhaltens war, die durch Reduktion von außerehelichem, kommerziellem und gelegentlichem Sex zu einer deutlichen Reduktion der Anzahl von Sexualpartnern führte.
Weltweit
| Mit HIV/AIDS lebende Erwachsene und Kinder (Schätzungen¹) | ||||||||
|---|---|---|---|---|---|---|---|---|
| Globale Verteilung | 2001 | 2002 | 2003 | 2004 | 2005 | 2006 | 2007 | 2008 |
| Subsahara-Afrika | 23.800.000 | 24.400.000 | 25.000.000 | 25.400.000 | 25.800.000 | 24.700.000 | 22.500.000 | 22.400.000 |
| Süd- und Südostasien | 5.900.000 | 6.400.000 | 6.500.000 | 7.100.000 | 7.400.000 | 7.800.000 | 4.000.000 | 3.800.000 |
| Latein-Amerika | 1.400.000 | 1.500.000 | 1.600.000 | 1.700.000 | 1.800.000 | 1.700.000 | 1.600.000 | 2.000.000 |
| Osteuropa und Zentralasien | 890.000 | 1.000.000 | 1.300.000 | 1.400.000 | 1.600.000 | 1.700.000 | 1.600.000 | 1.500.000 |
| Ostasien | 680.000 | 760.000 | 900.000 | 1.100.000 | 870.000 | 750.000 | 800.000 | 850.000 |
| Nordamerika | 950.000 | 970.000 | 1.000.000 | 1.000.000 | 1.200.000 | 1.400.000 | 1.300.000 | 1.400.000 |
| West- und Mitteleuropa | 540.000 | 600.000 | 580.000 | 610.000 | 720.000 | 740.000 | 760.000 | 850.000 |
| Nordafrika und Naher Osten | 340.000 | 430.000 | 480.000 | 540.000 | 510.000 | 460.000 | 380.000 | 310.000 |
| Karibik | 400.000 | 420.000 | 430.000 | 440.000 | 300.000 | 250.000 | 230.000 | 240.000 |
| Ozeanien | 24.000 | 28.000 | 32.000 | 35.000 | 74.000 | 81.000 | 75.000 | 59.000 |
| ¹Alle Zahlen von UNAIDS (rot: Zunahme gegenüber dem Vorjahr; orange: Gleichstand gegenüber dem Vorjahr; grün: Abnahme gegenüber dem Vorjahr) | ||||||||
Im südlichen Afrika ist die Rate am höchsten. Die Rate der schwangeren HIV-Infizierten unter 20 Jahren ist in Südafrika auf 15,4 % gesunken (1998: 21 %); dies bedeutet, dass Aufklärungsprogramme langsam Erfolge zeigen. Jedoch sind die AIDS-Raten bei älteren Frauen immer noch sehr hoch. 32 % der Frauen zwischen 24 und 29 Jahren sind derzeitig mit der Krankheit infiziert. Insgesamt sind 20 % der Bevölkerung Südafrikas mit HIV infiziert. Das Land mit der weltweit höchsten AIDS-Rate ist das benachbarte Swasiland, wo 2005 42 % der Bevölkerung infiziert waren.
Deutschland
| Statistische Größe | Zahl |
|---|---|
| HIV-Infizierte | 73.000 (100 %) |
| Davon Männer | 59.000 (81 %) |
| Davon Frauen | 14.000 (19 %) |
| Darunter Kinder | 200 (0,3 %) |
| Verteilung nach Infektionsrisiko | |
| Männer, die Sex mit Männern haben | 46.500 (64 %) |
| Heterosexuell Infizierte | 10.500 (14,3 %) |
| Personen aus Hochprävalenzregionen | 9.000 (12,3 %) |
| Intravenös Drogenabhängige | 6.800 (9,4 %) |
| Durch Transfusionen Infizierte | 450 (0,6 %) |
| Durch Mutter-Kind-Kontakt Infizierte | 420 (0,6 %) |
| Neuinfektionen 2011 | |
| Gesamt | 2.700 |
| Davon Männer | 2.300 (85 %) |
| Davon Frauen | 400 (15 %) |
| AIDS-Todesfälle | |
| Seit Beginn der Epidemie | 27.000 |
| Im Jahr 2011 | 500 |
| Medizinische Versorgung 2011 | |
| Geschätzte Zahl an Personen, denen ihre HIV-Infektion nicht bekannt ist |
14.000 (19,2 %) |
| HIV-Infizierte unter antiretroviraler Therapie | 52.000 (71,0 %) |
| Quelle: |
|
In den 1990er Jahren kam es jährlich zu etwa 2000 HIV-Neuinfektionen. Von 2000 bis 2007 stieg die Zahl der Neuinfektionen jährlich kontinuierlich an, besonders bei Männern, die Sex mit Männern haben (MSM). Seit 2007 scheinen sich die jährlichen Neuinfektionen bei einem Wert von etwa 2500–3000 zu stabilisieren. In Deutschland zählt AIDS im Vergleich mit anderen Todesursachen mit etwa 500 Toten pro Jahr zu den eher unbedeutenden Todesursachen. Nach aktuellen Daten des Berliner Robert Koch-Instituts (RKI) erlagen bis dato (Stand Ende 2011) etwa 27.000 Menschen in Deutschland den Folgen der Immunschwäche. Im Jahr 2011 waren nach Daten des RKI geschätzt 73.000 Menschen in Deutschland (0,09 % der Gesamtbevölkerung, das heißt ein Mensch auf 1155) mit HIV infiziert. Die Inzidenz an Neuinfektionen ist dabei regional sehr unterschiedlich. In Großstädten (Berlin, Köln, München, Hamburg, Frankfurt am Main) betrug sie im Jahr 2011 zwischen 10 und 15/100.000 Einwohnern, während im ländlichen Raum häufig nur ein Zehntel dieses Wertes erreicht wurde.
Von den etwa 2.700 Neuinfizierten im Jahr 2011 waren nach Schätzungen des RKI etwa 85 % Männer, von denen 74 % Männer sind, die Sex mit Männern haben; etwa 20 % der Übertragungen kamen durch heterosexuellen Geschlechtsverkehr zustande, 6 % der Infektionen durch infizierte Spritzen bei intravenösem Drogenkonsum und weniger als 1 % Übertragungen von der Mutter auf das Kind während der Schwangerschaft und der Geburt. Das Infektionsrisiko für Männer, die Sex mit Männern haben, ist damit signifikant höher, als bei ungeschütztem Geschlechtsverkehr bei heterosexuellen Paaren. Aufgrund der Anzahl der Infektionen können HIV und AIDS aber längst nicht mehr als Minderheiten-Problem angesehen werden, sondern betreffen grundsätzlich alle gesellschaftlichen Gruppen und sozialen Schichten. Die vom RKI ermittelten Daten zur Verbreitung von HIV und AIDS sind nur begrenzt mit früher publizierten Schätzungen vergleichbar, da zusätzliche Daten und Informationen sowie die Anpassung der Erhebungsmethodik die Berechnungen von Jahr zu Jahr verändern. Das RKI passt daher die alljährliche Auswertung der sich verändernden Datenlage an und interpoliert beispielsweise Daten aus den Anfangszeiten der HIV-Epidemie, um eine Gesamttendenz sichtbar zu machen.
Es gibt Befürchtungen, dass die Infektionsrate ansteigt, da zum einen die Aufklärungswelle der 1990er Jahre verebbt sei und sich zum anderen gerade bei Jugendlichen eine erstaunliche Unkenntnis in Bezug auf die Infektionswege und Infektionsrisiken, insbesondere bei ungeschütztem Geschlechtsverkehr, zeigt. So meinte jeder fünfte Jugendliche, dass man einem HIV-Positiven „die Krankheit ansehen könne“. Hinzu kommt eine Verharmlosung und gelegentliche Faszination von Gefahren, die bei manchen Heranwachsenden, aber insbesondere auch bei Erwachsenen zu bewusst risikoreicherem Verhalten (Barebacking und sogenanntes Bugchasing bzw. Pozzen) führt.
Grund zur Besorgnis gibt weiterhin der kontinuierliche Anstieg von anderen sexuell übertragbaren Krankheiten. Nicht nur, dass sich damit das Risiko einer HIV-Infektion erhöht, es zeigt auch, dass die Akzeptanz von Kondomen rückläufig ist und die Präventionsmaßnahmen der letzten Jahrzehnte offensichtlich an Wirkung verlieren.
Österreich
Anfang 2008 leben etwa 12.000 bis 15.000 HIV-Infizierte in Österreich, etwa die Hälfte davon in Wien. Die Zahl der Neuinfizierungen beträgt seit 2003 etwa 450 pro Jahr (2007: 515). Die niedrigste Rate war 1997 mit 297, die höchste 1993 mit 561 Neuinfektionen. Der Anstieg der Neuinfektionen kann durch das Ende der Aufklärungswelle der 1990er Jahre erklärt werden, sie bleibt mittlerweile aber relativ konstant. Zwischen 1983 und dem 5. Mai 2008 sind in Österreich 2608 Menschen an AIDS erkrankt und 1468 gestorben. Von 2003, mit 50 neuen Erkrankungen, stiegen sie im Jahr 2004 auf 65 an.
2006 erfolgten fast 42 % der Neuinfektionen über heterosexuelle Kontakte (1998 waren es 27 %), 28,6 % über homosexuelle Kontakte und 20,5 % über intravenösen Drogenkonsum.
Pro Jahr werden in Österreich rund eine Mio. HIV-Antikörper-Tests durchgeführt (500.000 davon durch Spenden finanziert). Ein Problem ist, dass die Tests oft in der falschen Zielgruppe durchgeführt werden (Pensionisten). Einerseits wird sehr viel getestet, andererseits wird bei vielen der Betroffenen die HIV-Infektion erst im Zuge der tatsächlichen Erkrankung bekannt.
Schweiz
In der Schweiz wurden im Jahr 2005 702 positive HIV-Tests gemeldet. Seit 2002 hat die Anzahl der Neuansteckungen von 791 leicht abgenommen. Besonders stark betroffen sind die Kantone Zürich, Waadt und Genf.
Bei den Männern sind 2005 die meisten Ansteckungen mit 49,1 % nach homosexuellem Geschlechtsverkehr zu verzeichnen. Seit 2003 zeigt sich in dieser Gruppe eine Zunahme von 13,9 % und bewegt sich damit über dem Höchststand von 1994. Die Anzahl der Ansteckungen nach heterosexuellem Kontakt folgt mit 38,1 %. Diese Gruppe stieg nach 2002 wieder an, sank aber 2005 wieder und scheint sich auf gleichbleibend hohem Niveau zu halten. Die Ansteckungen nach Drogenkonsum sinken seit 2003 weiter auf 9,7 %.
Bei den Frauen ist das Ansteckungsrisiko bei heterosexuellem Kontakt mit 80,6 % am größten und stieg seit 2002 um 10,7 %. Die Infizierungen nach Drogenkonsum bleiben mit 11,1 % auf konstantem Niveau.
Bei Ansteckungen nach homosexuellen Kontakten sind hauptsächlich Bürger aus der Schweiz mit etwa 72 % betroffen, gefolgt mit 15 % von Personen aus der EU. Das Verhältnis bewegt sich bei Ansteckungen nach Drogenkonsum etwa im gleichen Verhältnis (63 % aus der Schweiz und 20,4 % EU). Bei den heterosexuellen Beziehungen zeigt sich jedoch ein stark größerer Anteil an ausländischen Personen. Besonders stark betroffen sind Personen aus der Subsahara mit 41 %.
Geschichte
Entstehungstheorien
Mit dem menschlichen HI-Virus fast identisch ist das bei Affenarten vorkommende simiane Immundefizienz-Virus (SIV). Es dürfte seit mindestens 32.000 bis 75.000 Jahren existieren, wie durch Vergleiche von der vor Afrika liegenden Insel Bioko und vom afrikanischen Festland stammenden Proben ermittelt wurde. Man unterscheidet vor allem das afrikanische SIVcpz (von chimpanzee), von dem HIV-1 abstammt, und das asiatische SIVmac (von macaque), von dem das seltenere HIV-2 abstammt.
Genetische Analysen von Virologen der University of Alabama at Birmingham aus dem Jahre 2003 zeigen, dass SIVcpz eine Kombination aus zwei Virusstämmen ist, die in Weißnasenmeerkatzen und Halsbandmangabe vorkommen. Da diese Arten von Schimpansen gejagt und gefressen werden, müssen sich die Schimpansen mit den zwei Virusstämmen infiziert haben, aus denen sich dann in ihrem Körper das SI-Virus gebildet hat.
Die Übertragung dieses SI-Virus auf den Menschen erfolgte nach Ansicht der Forscher wohl bereits vor den 1930er Jahren durch Verletzungen bei der Jagd oder Verzehr von Schimpansen, wobei es Hinweise gibt, dass dies in isolierten Fällen bereits früher geschah. Weitere wissenschaftliche Untersuchungen ergaben, dass das HI-Virus zuerst in Westafrika auftrat, aber es ist nicht mit letzter Sicherheit geklärt, ob es nicht mehrere Virusherde gab. Neue sogenannte phylogenetische Untersuchungen, also Verwandtschaftsvergleiche zwischen den unterschiedlichen Subtypen von HIV und zwischen HIV und SIV, lassen vermuten, dass mehrere unabhängige Übertragungen vom Schimpansen auf den Menschen in Kamerun und/oder dessen Nachbarländern stattfanden.
Die älteste Blutprobe, die nachgewiesenermaßen HIV-Antikörper enthält, wurde 1959 im Kongo von einem erwachsenen Menschen genommen. Die Authentizität dieser Probe ist jedoch nicht sicher geklärt. In alten Paraffin-DNA-Proben konnten bei einer im Kongo gestorbenen Frau (1960, Lymphknotengewebe), einem amerikanischen Jugendlichen (1969) und einem norwegischen Matrosen (1976) HIV-Gene gefunden werden. Neben der derzeit anerkannten Theorie gab es insbesondere in den 1980er Jahren Theorien, denzufolge eine natürliche HIV-Entstehung in Afrika unwahrscheinlich sei.
Erste Infektionen
Die früheste dokumentierte Infektion mit HIV-1 wurde anhand 1959 entnommener Blutproben eines Mannes aus Léopoldville (Belgisch-Kongo) nachgewiesen. Der Vergleich mit späteren Proben von einer 1976 an AIDS verstorbenen Familie eines norwegischen Seemanns deutet auf Divergenz von einem gemeinsamen Vorfahren aus den 1940er bis frühen 1950er Jahren hin. Es wird angenommen, dass HIV-1 einige Jahre zuvor auf den Menschen übersprang. Der genetische Unterschied zwischen HIV-1 und HIV-2 deutet jedoch auch darauf hin, dass diese Subtypen bereits weitaus früher divergierten.> Die Genetikerin Bette Korber vom Los Alamos National Laboratory datierte im Jahre 2000 anhand der Probe von 1959 die erste Übertragung auf etwa das Jahr 1931. Der Evolutionsbiologe Michael Worobey von der University of Arizona datierte im Jahre 2008 mit Hilfe einer zusätzlichen Probe aus dem Jahre 1960 die erste Übertragung auf die Zeit zwischen 1884 und 1924. Er vermutet dadurch, dass die Gründung der Kolonialstädte dem Virus half, Fuß zu fassen.
Erste Krankheitsbeschreibungen
1981 beschrieb Michael S. Gottlieb in der am 5. Juni erschienenen Ausgabe des Morbidity and Mortality Weekly Report, einem wöchentlichen Bulletin der US-Gesundheitsbehörde Centers for Disease Control and Prevention (CDC), eine Häufung einer seltenen Form der Lungenentzündung. Diese durch den Pilz Pneumocystis jirovecii ausgelöste Form befällt nahezu ausschließlich Patienten mit schwerwiegender Immunschwäche, wurde von Gottlieb jedoch bei fünf zuvor gesunden, homosexuellen Männern in Los Angeles festgestellt. Ähnliche Berichte aus anderen US-amerikanischen Städten folgten. Zudem wurden verstärkt auch andere opportunistische Erkrankungen – etwa Kaposi-Sarkome – festgestellt, die überwiegend Patienten mit geschwächtem Immunsystem befallen.
Schon früh wurde eine erworbene Immunschwächeerkrankung als wahrscheinliche Ursache in Betracht gezogen, die sexuell übertragen werden kann. Anfangs gab es keinen offiziellen Namen, und es wurde oft auf die Namen der Krankheiten verwiesen, wie Lymphadenopathie oder Kaposi-Sarkom, teilweise mit einem Verweis auf homosexuelle Männer; die Task Force der CDC wurde Kaposi's Sarcoma and Opportunistic Infections benannt, welches auch für Berichte genutzt wurde. In der allgemeinen Presse wurde unter anderem ab Mai von Gay Related Immune Deficiency (GRID) oder Gay People's Immuno Deficiency Syndrome (GIDS) geschrieben. Weitere epidemiologische Untersuchungen in den USA zeigten jedoch, dass die Krankheit auch unter Hämophilen, Empfängern von Blut (zum Beispiel durch Bluttransfusionen) und heterosexuellen Drogenabhängigen auftrat, was neben sexueller auch eine parenterale Übertragung nahelegt. Auf der Suche nach einem Namen kreierte die CDC auch den Namen „the 4H disease“, verweisend auf die vermeintlichen Hauptbetroffenengruppen: Haitianer, Homosexuelle, Hämophile und Heroin-Süchtige. Am 27. Juli 1982 einigte man sich bei einer Konferenz auf den beschreibenden Namen Acquired Immune Deficiency Syndrome und die Abkürzung AIDS, was ab August 1982 verwendet wurde und ab September 1982 bei der CDC, bzw. im französischen Sprachraum als „Syndrome d’Immuno-Déficience Acquise“ (SIDA) in Erscheinung tritt.
In Deutschland berichtete der Spiegel erstmals am 31. Mai 1982 unter dem Titel „Der Schreck von drüben“ und die Krankheit wurde erstmalig im Juli 1982 bei einem Patienten aus Frankfurt am Main diagnostiziert. In Österreich werden die ersten beiden Fälle im April 1983 gemeldet und anlässlich des ersten Verstorbenen berichteten im Frühjahr 1983 erstmals die österreichischen Tageszeitungen. In der Folge erstellen die HOSI Wien mit Klaus Wolff und Christian Kunz ein an schwule Männer gerichtetes Informationsblatt und geben es gemeinsam mit der „Wiener Arbeitsgemeinschaft für Volksgesundheit“ heraus. Es ist die erste Informationsbroschüre Europas.
Isolation des Virus und erste Therapien
1983 isolierte eine französische Forschergruppe um Françoise Barré-Sinoussi und Luc Montagnier ein zuvor unbekanntes Retrovirus, das Lymphadenopathie-Virus (LAV), das sie als Ursache für AIDS vermuteten. Eine kausale Beziehung zwischen dem Virus und der Immunschwächeerkrankung wurde kurze Zeit später behauptet. 1984 wurde im US-Krebsinstitut ein bei AIDS-Patienten entdecktes Virus Human T-cell Lymphotropic Virus-III (HTLV-III) genannt. Im März 1985 stellte sich aufgrund weiterer Berichte zu LAV und HTLV-III heraus, dass diese identisch sind. 1985 erhielt Robert Gallo das US-Patent für den ersten ELISA-Antikörper-Test, der von der US-Zulassungsbehörde zugelassen wurde. Im Jahr 1986 wurde für das Virus der Name Humanes Immunschwächevirus (HIV) etabliert. Ein Jahr später, 1987, wurde mit AZT (Retrovir) das erste Therapeutikum zugelassen. 1989 wurde bei HIV-Patienten die Pentamidin-Inhalation zur Prophylaxe der Pneumocystis-Pneumonie eingeführt.
Im Januar 1982 wurde mit Gay Men’s Health Crisis (GMHC) die älteste Organisation zur Unterstützung von Menschen mit AIDS in New York City gegründet. 1983 wurde in Berlin die AIDS-Hilfe gegründet, 1985 folgten jene in Wien und die Aids-Hilfe Schweiz. Im selben Jahr fand in Atlanta (USA) die erste Welt-AIDS-Konferenz statt, und mit Rock Hudson starb der erste Top-Prominente infolge der Immunschwäche. Aus der GMHC spaltete sich im März 1987 die aktivistische politische Initiative Act Up ab.
Als bei einer routinemäßigen Pressekonferenz am 15. Oktober 1982 im Weißen Haus eine Frage über AIDS gestellt wurde, wurde das Ganze ins Lächerliche gezogen. Der damalige US-Präsident Ronald Reagan fand im Mai 1987 bei der 3. Internationalen Aids-Konferenz in Washington erstmals offizielle Worte. Elizabeth Taylor hatte ihm zuvor einen flehenden Brief geschrieben, mitzuhelfen das archaische Stigma („Krankheit von Homosexuellen“) aufzubrechen. Bis dahin waren bereits 36.058 US-Bürger diagnostiziert worden, 20.849 an den Folgen gestorben und die Infektion wurde in 113 Ländern festgestellt.
Seit 1987 ist das Global Program on HIV/AIDS der WHO aktiv, aus dem 1996 UNAIDS entstand. Im Jahr 1988 wurde von der WHO der 1. Dezember zum Welt-AIDS-Tag erklärt. Der nachfolgende US-Präsident Bill Clinton erklärte im Jahr 2000 Aids zum „Staatsfeind“, da die Epidemie Regierungen stürzen, Chaos in der Weltwirtschaft verursachen und ethnische Konflikte auslösen könne.
Gesellschaftliche Entwicklung
Zu Anfang galt die Erkrankung in der öffentlichen Wahrnehmung als Problem von „Randgruppen“ wie Homosexuellen und Drogenabhängigen. Dies änderte sich jedoch auf dramatische Weise durch das Aufkommen von HIV-Tests. Denn auch Menschen ohne klinische Symptome hatten Antikörper, was auf eine symptomfreie Latenzzeit von mehreren Jahren hindeutete, in der das Virus möglicherweise auch weitergegeben wurde. 1984 ergaben Untersuchungen, dass AIDS in Kinshasa bei Männern und Frauen gleich häufig auftrat, unabhängig von Drogenkonsum und Bluttransfusionen.
In den USA wurde 1985 berichtet, dass bei untersuchten Hämophiliekranken („Blutern“), die sich durch Blutkonserven infiziert hatten, die Ansteckungsrate der Ehefrauen bei 70 % lag. Die Erkenntnis, dass die Ansteckungsgefahr bei heterosexuellem Geschlechtsverkehr deutlich höher zu sein schien als zunächst angenommen, führte zu einem großen öffentlichen Interesse. Die Kombination aus den nun bekannten Ansteckungswegen und langer Latenszeit ließ epidemiologische Hochrechnungen ein pessimistisches Bild zeichnen.
Die jährliche Verdopplung von Neuerkrankungen hielt in Deutschland nur von 1984 bis 1987 an, danach verlief der Anstieg der Zahl von Erkrankten weniger steil, bis sich die Zahlen im Jahre 1993 auf etwa 2000 einpendelte. Dadurch änderte sich auch schnell wieder das öffentliche Interesse an AIDS. 2003 steckten sich weltweit ungefähr 4,8 Millionen Menschen neu mit dem Virus an, im selben Jahr starben etwa 2,9 Millionen Menschen daran.
Rote Schleife wird Symbol für Kampf gegen AIDS
Im Jahr 1990 wurde aus Protest gegen die Diskriminierung von HIV-Infizierten auf der AIDS-Konferenz in San Francisco das Red Ribbon, ein rotes Armband, etabliert. Ein Jahr später wurde die Rote Schleife international zum Symbol für den Kampf gegen AIDS. 1992 wurde aufgrund der US-Einreisebestimmungen der Welt-AIDS-Kongress von Boston nach Amsterdam verlegt. Außerdem wurde im Gedenken an Freddie Mercury von den verbleibenden Queen-Mitgliedern die Stiftung Mercury Phoenix Trust gegründet.
Veränderungen nach Einführung des PCR-Tests auf HIV
1994 wurde die HIV-PCR als wichtiger diagnostischer Test für die Therapiekontrolle des Infektionsverlaufes etabliert. Im folgenden Jahr, 1995, kam der erste HIV-Proteasehemmer, Saquinavir, in den USA auf den Markt. Im folgenden Jahr wurde Nevirapin als erster nicht-nukleosidischer Reverse-Transkriptase-Hemmer zugelassen. Durch die intensive Kombinationstherapie nahm die Sterberate in den USA 1997 drastisch ab. 2003 wurde mit Enfuvirtid (Fuzeon) der erste Fusionshemmer in den USA zugelassen. 2004 wurde von der WHO die Initiative 3 by 5 gestartet: Drei Millionen Infizierte sollten im Jahr 2005 mit Medikamenten versorgt werden.
Abweichende Sichtweisen
Trotz gesicherter wissenschaftlicher Erkenntnisse bestreitet eine sehr geringe Zahl von Wissenschaftlern entweder die Existenz von HIV oder den Zusammenhang von HIV und AIDS. Dazu gehören insbesondere der Retrovirologe Peter Duesberg und der Chemiker Kary Mullis. Ihre Thesen beeinflussten den ehemaligen Präsidenten Südafrikas, Thabo Mbeki, der Duesberg 2001 zum Mitglied der südafrikanischen AIDS-Beratungskommission ernannte. In Südafrika liegt die Verbreitungsrate von HIV/AIDS bei über 20%, etwa 370.000 Menschen starben 2003 allein in Südafrika an AIDS. Mbeki bestreitet selber vehement den Zusammenhang zwischen HIV und AIDS. Kary Mullis ist für die Entdeckung des Polymerase-Kettenreaktion (PCR)-Verfahrens bekannt, mit dem unter anderem HI-Viren im Körper von Betroffenen nachgewiesen werden. Nachdem er sich aber als mögliches Entführungsopfer von Außerirdischen bezeichnet und seine Vorliebe für Astrologie bekundet hat, hat seine Reputation als Wissenschaftler stark gelitten.
Die Position der Aids-Leugner wird von der überwältigenden Mehrheit der Mediziner als gefährliche Verschwörungstheorie eingestuft und scharf kritisiert. In Südafrika verzögerte sich wegen der durch das Leugnen des Zusammenhangs zwischen HIV und AIDS geprägten Gesundheitspolitik die Einführung der AIDS-Therapie bis 2004. Man nimmt an, dass es als Folge dieser Politik zwischen 2000 und 2005 zum frühzeitigen AIDS-Tod von mindestens 330.000 Menschen gekommen ist und dass durch fehlende HIV-Infektionsprävention 35.000 Babys mit HIV infiziert wurden.
Sozialethische Beurteilung
Das Krankheitssyndrom AIDS hat sich weltweit zu einer ernsten Herausforderung für direkt Betroffene, für die medizinische Wissenschaft, aber auch für all jene, die erkrankte Personen betreuen oder mit ihnen zusammenleben, entwickelt.
Fernab von jeder Stigmatisierung AIDS-kranker Patienten gilt es, Mittel und Wege zu finden, ihnen besser wirksam zu helfen: Sei es durch immer noch nicht ausreichend verfügbare therapeutische Maßnahmen, sei es im Sinn der symptomatischen Therapie und Palliativmedizin. Geboten ist zudem umfassende und wirksame Prävention.
Die Suche nach einer ethisch vertretbaren AIDS-Bekämpfungsstrategie führt zu teils gegenteiligen Ergebnissen: Die einen betonen die unbedingte Notwendigkeit eines ausschließlich oder doch primär „technischen“ Schutzes gegen die Ausbreitung der Krankheit. Andere sehen diese Antwort als nicht ausreichend an bzw. lehnen diese aus Gründen einer religiösen Ethik ab. Sie betonen den Wert der dauerhaften ehelichen Treue neu bzw. fordern im konkreten Fall auch zeitweise oder völlige Enthaltsamkeit ein. Die Propagierung von Kondomen als Schutz gegen AIDS sei vom religiös-christlichen Standpunkt aus bedenklich. Man argumentiert, auf diese Weise werde ein mit Promiskuität und gewissen sexuellen Praktiken assoziierter verantwortungsloser Lebensstil gefördert, der die eigene Person sowie andere Menschen einer todbringenden Gefahr aussetze. Diese Forderungen sind allerdings im Kontext der insbesondere in der katholischen Kirche verbreiteten Morallehre zu sehen, die Promiskuität negativ konnotiert. Da die katholische Kirche während der Ausbreitungsphase von AIDS in Afrika erheblichen gesellschaftlichen Einfluss hatte, sind durch die jahrelange Behinderung von Aufklärung und Vorbeugung (etwa von Sexualaufklärung an den Schulen und der Verteilung von Kondomen) zahlreiche Neuansteckungen in Kauf genommen worden. In dem 2010 erschienenen Interview-Buch Licht der Welt betonte das Oberhaupt der römisch-katholischen Kirche Papst Benedikt XVI., dass er die Verwendung von Kondomen „natürlich nicht als wirkliche und moralische Lösung“ ansehe. Ein begründeter Einzelfall für eine Ausnahme von dieser Haltung könne aber etwa sein, dass männliche Prostituierte ein Kondom verwenden. Dies könne dann „ein erster Schritt zu einer Moralisierung“ sein und helfen, ein Bewusstsein zu entwickeln, „dass nicht alles gestattet ist und man nicht alles tun kann, was man will“. Grundsätzlich lehnte der Papst die Verwendung von Kondomen im Kampf gegen die weltweite AIDS-Epidemie jedoch weiterhin ab.
HIV-positive und an AIDS erkrankte Menschen sehen sich des Öfteren einer Stigmatisierung und einer Diskriminierung ausgesetzt. Vor allem in Österreich hat sich dafür der Begriff des „sozialen AIDS“ erhalten. Sogar prinzipiell behandlungspflichtige Ärzte verweigern in Einzelfällen die Behandlung („[…] keine Lust habe sich solch einer Gefahr auszusetzen […]“). In Hanau und dem Main-Kinzig-Kreis wurde hierzu eine Umfrage mit telefonischer Kontaktaufnahme und Fragebogen gestartet, allerdings mit geringem Rücklauf. Praxismitarbeiter wussten nichts mit den Begriffen HIV und AIDS anzufangen. Der Hauptgrund für eine Ablehnung war der angebliche höhere Hygieneaufwand bei der Behandlung von Menschen mit HIV. Dabei ist in einer Praxis generell so hygienisch zu arbeiten, dass dort kein Übertragungsrisiko besteht. Etwa 30 % der Infizierten wissen selbst noch nichts davon. Auch in einer deutschen Universitätsklinik waren die Schwestern 2011 der Meinung nach Operationen an und Duschen von HIV-positiven Patienten die jeweiligen Räume komplett desinfizieren zu müssen und wollten wegen des angeblich erhöhten Aufwands das Duschen verweigern. Öffentlichkeitswirksam aufklären wollen das ganze Jahr über die AIDS-Hilfen und andere Organisationen. Auch der Welt-AIDS-Tag am 1. Dezember wird dazu genutzt und der inzwischen international beachtete Life Ball in Wien will nicht nur Spenden sammeln, sondern über die Medienpräsenz auch mit positiven Slogans gegen die Stigmatisierung ankämpfen. 2010 zog der AIDS-Aktivist Carlos Fassanelli samt Partner bei Big Brother ein, um dadurch ein großes Publikum zu erreichen.

Basierend auf einem Artikel in Wikipedia.de

© biancahoegel.de
Datum der letzten Änderung: Jena, den: 23.06. 2025