
Phosphor(V)-sulfid
| ||||||||||
| MAK | DFG/Schweiz: 1 mg/m3 (gemessen als einatembarer Staub)[3][4] | |||||||||
| Toxikologische Daten | 389 mg/kg (LD50, Ratte, oral)[1] | |||||||||
Phosphor(V)-sulfid ist eine chemische Verbindung, die vorwiegend zur Synthese anderer Produkte verwendet wird. Sie kommt gewöhnlich als P4S10-Molekül vor und wird oft auch fälschlicherweise Di-Phosphorpentasulfid genannt.
| Strukturformel | ||
|---|---|---|
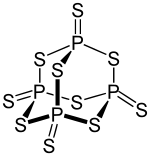
| ||
| Allgemeines | ||
| Name | Phosphor(V)-sulfid | |
| Andere Namen |
| |
| Summenformel | P4S10 | |
| Kurzbeschreibung | gelbliches kristallines Pulver[1] | |
| Externe Identifikatoren/Datenbanken | ||
| CAS-Nummer | | |
| EG-Nummer | 215-242-4 | |
| ECHA-InfoCard | | |
| PubChem | | |
| Eigenschaften | ||
| Molare Masse | 444,54 g/mol−1 | |
| Aggregatzustand | fest | |
| Dichte | 2,09 g/cm3[1] | |
| Schmelzpunkt | 286–290 °C[1] | |
| Siedepunkt | 513–515 °C[1] | |
| Löslichkeit | in Wasser Zersetzung[1] | |
Darstellung
Phosphor(V)-sulfid wird durch Zusammenschmelzen der Elemente weißer Phosphor und Schwefel bei ca. 300 °C gewonnen.[5]
Eigenschaften
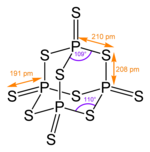
Die Struktur entspricht der von Phosphorpentoxid.
Das leichtentzündliche[1] und gesundheitsschädliche Phosphor(V)-sulfid hydrolysiert mit Wasser (auch Luftfeuchtigkeit) zu übelriechendem und sehr giftigem Schwefelwasserstoff (H2S) und Phosphorsäure. Phosphor(V)-sulfid ist in Kohlenstoffdisulfid gut löslich.[3] P4S10 kann schon durch Reibung in Brand geraten, ebenso kann der Kontakt mit feuchter Luft zur Selbstentzündung führen.[1]
Verwendung
Phosphor(V)-sulfid wird für die Synthese schwefel- und phosphorhaltiger organischer Substanzen verwendet, insbesondere Insektizide und Zinkdialkyldithiophosphate (Additive von Schmierstoffen). Phosphor(V)-sulfid kann auch zur Herstellung des Nervenkampfstoffs VX verwendet werden („Dual Use“). Zur präparativen Gewinnung von Thiophenen werden 1,4-Dicarbonylverbindungen ebenfalls mit Phosphor(V)-sufid umgesetzt. Amide lassen sich durch Umsetzung mit Phosphor(V)-sulfid in Thionamide umwandeln:

Einzelnachweise
- ↑ Hochspringen nach: a b
c d e
f g h
i j Eintrag zu
 Diphosphorpentasulfid in der GESTIS-Stoffdatenbank
des Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung. (JavaScript erforderlich)
Diphosphorpentasulfid in der GESTIS-Stoffdatenbank
des Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung. (JavaScript erforderlich)
- ↑ Eintrag zu
 Diphosphorus pentasulphide im
Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA).
Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung
Diphosphorus pentasulphide im
Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA).
Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung
 erweitern.
erweitern.
- ↑ Hochspringen nach: a b A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 788.
- ↑ Schweizerische Unfallversicherungsanstalt (Suva):
 Grenzwerte – Aktuelle MAK- und BAT-Werte
(Suche nach 1314-80-3 bzw. Phosphor(V)-sulfid).
Grenzwerte – Aktuelle MAK- und BAT-Werte
(Suche nach 1314-80-3 bzw. Phosphor(V)-sulfid).
- ↑ G. Brauer (Hrsg.), Handbook of Preparative Inorganic Chemistry 2nd ed., vol. 1, Academic Press 1963, S. 565–568.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 18.11. 2024


