
Thioketale
| Thioketale |
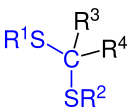 Allgemeine Struktur von Thioketalen (genauer: Dithioketale). Dabei gilt: R1 bis R4 sind Organyl-Reste (Alkyl-Reste, Aryl-Reste, Arylalkyl-Reste etc.), jedoch kein Wasserstoffatom. [Bei R3 und/oder R4 Wasserstoff: Thioacetal (genauer: Dithioacetal)]. |
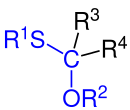 Allgemeine Struktur der Monothioketale. Dabei gilt: R1 bis R3 sind Organyl-Reste (Alkyl-Reste, Aryl-Reste, Arylalkyl-Reste etc.), jedoch kein Wasserstoffatom. (Bei R3 und/oder R4 Wasserstoff: Monothioacetal). |
Als Thioketal (genauer: Dithioketale) bezeichnet man in der Chemie ein Ketal in dem beide acetalischen Sauerstoffatome durch Schwefelatome ersetzt wurden.[1] Bei den Monothioketalen ist nur eines der beiden acetalischen Sauerstoffatome eines Ketals durch ein Schwefelatom ersetzt.
Heute werden Thioketale meist unter dem Begriff Thioacetale subsumiert, obwohl sich erstere von Ketonen und nicht von Aldehyden ableiten.
Synthese
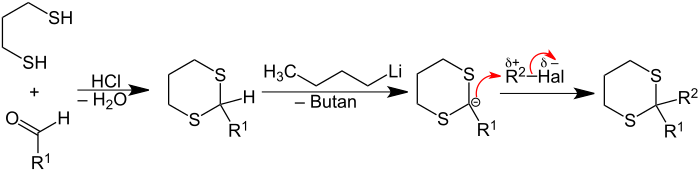
Zur Synthese eines Thioketals wird ein Keton mit einem ein- oder zweiwertigen Thioalkohol säurekatalysiert oder in Gegenwart von Zinkchlorid unter Wasserabspaltung umgesetzt.[1] Alternativ werden bei der Corey-Seebach-Reaktion Thioacetale zuerst mit einer Base deprotoniert. Das so gebildete Anion liefert bei der anschließenden Umsetzung mit einem Alkyl-Halogenid das entsprechende Thioketal:
Verwendung
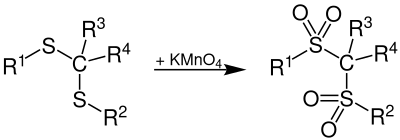
Die Oxidation von Thioketalen z. B. mit Kaliumpermanganat liefert Disulfone:[2]
Durch die Reduktion von Thioketalen mit Raney-Nickel entstehen Alkane.
Einzelnachweise
- ↑ Hochspringen nach: a b Brockhaus ABC Chemie, VEB F. A. Brockhaus Verlag Leipzig 1965, Seite 1410.
- ↑ R. L. Shriner, J. M. Cross, Elmer H. Dobratz: Dialkyl
bis-(Carbethoxymethanesulfonyl)-methanes. In: Journal of the American Chemical Society.
Band 61,
Nr. 8, 1939,
S. 2001–2003,
doi:
 10.1021/ja01877a015.
10.1021/ja01877a015.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 18.09. 2024