Periodate
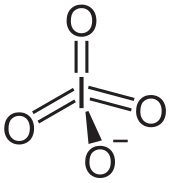
Periodate sind die Salze verschiedener Periodsäuren; je nach Säure wird zwischen Orthoperiodaten (IO65−), Metaperiodaten (IO4−), Dimesoperiodaten (I2O94−) und Mesoperiodaten (IO53−) unterschieden.
Darstellung
Periodate können durch elektrochemische Oxidation aus Iodaten hergestellt werden; hierbei besteht die Anode aus Bleidioxid. Auch bei der Oxidation von Iodaten mit Chlor entsteht Periodat. In alkalischer Lösung bilden sich bei Temperaturen um 100 °C aus Iodaten und Chlor oder Hypochlorit saure Salze der Form M5-nHnIO6 (mit n = 2,3).
Eigenschaften
Orthoperiodate sind in Wasser nur schwer löslich, wobei eine Hydrolyse eintritt; beim Erhitzen zersetzen sich die Salze. Periodate sind starke Oxidationsmittel. Im Gegensatz zu Perchloraten und Perbromaten, deren Reaktionen oft kinetisch gehemmt sind und trotz ausreichender Oxidationskraft eine erhebliche Aktivierungsenergie benötigen, sind die Reaktionen mit Periodaten relativ schnell.
Verwendung
Periodate dienen in der organischen Chemie als Oxidationsmittel, die C-C-Bindungen spalten können; hier wird vorwiegend Natriummetaperiodat (NaIO4) zur Glycolspaltung (Malaprade-Reaktion) und Darstellung von Desoxyribonucleotiden eingesetzt. Periodate sind weiterhin hochselektive Ätzmittel für bestimmte Ruthenium-haltige Oxide.
Beispiele
- Natriumperiodat NaIO4
- Kaliumperiodat KIO4
- Rubidiumperiodat RbIO4
Siehe auch


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 07.03. 2025