
Triphenylmethylgruppe
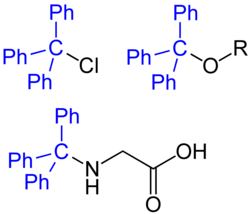
Die Triphenylmethylgruppe wird in der organischen Chemie kurz als Trityl-Rest bezeichnet. Er findet häufige Verwendung als Schutzgruppe innerhalb organischer Synthesestrategien, um unerwünschte Umsetzungen von freien Aminen zu verhindern. Haupteinsatzgebiet ist dabei der Aufbau von Peptiden aus geschützten Aminosäuren.
Das Triphenylmethylradikal (Gomberg-Radikal) ist ein mesomeriestabilisiertes, ungewöhnlich stabiles Radikal.[1]
Es wurde von Moses Gomberg 1900[2][3][4][5] entdeckt als frühes Beispiel organischer reaktiver Zwischenstufen, dem weitere folgten (Ketene 1905 durch Hermann Staudinger). Gomberg, der zeigte, dass Triphenylmethylchlorid und Zink ein stabiles Triphylmethyl-Radikal bildeten, fand dadurch damals große Aufmerksamkeit und wurde für den Nobelpreis vorgeschlagen.
Verwendung
Die Triphenylmethylgruppe lässt sich zum Schützen der Aminogruppe einer Aminosäure einfach in ein Molekül einführen, indem die Aminosäure mit zwei Äquivalenten Tritylchlorid in Gegenwart von Triethylamin in aprotischen Lösungsmitteln umgesetzt wird. Analog lassen sich Aminosäureester an der Aminogruppe tritylieren.
Hydroxygruppen in Alkoholen lassen sich als Tritylether schützen.[6]
Die Schutzgruppe ist unter vielen chemischen Reaktionsbedingungen stabil.
Abspaltung
Eine Abspaltung der Schutzgruppe ist unter milden Reaktionsbedingungen säurekatalysiert möglich, so mit Chlorwasserstoff oder Salzsäure, mit Trifluoressigsäure bei 0 bis −10 °C oder mit Eisessig in der Hitze. Eine hydrogenolytische Abspaltung der Triphenylmethyl-Schutzgruppe ist ebenfalls möglich.[7]
Einzelnachweise
- ↑ Ulrich Lüning: Organische Reaktionen, 2. Auflage, Elsevier GmbH, München 2007, ISBN 978-3-8274-1834-0, S. 19–23.
- ↑ Thomas T. Tidwell, The first century of Ketenes (1905-2005): the birth of a family of reactive intermediates, Angewandte Chemie International Edition, Band 44, 2005, S. 5778–5785.
- ↑ J. M. McBride, Tetrahedron, Band 30, 1974, S. 2009–2022.
- ↑ M. Gomberg, Ber. Deutschen Chem. Ges., Band 33, 1900, S. 3150–3163.
- ↑ M. Gomberg, J. Am. Chem. Soc., Band 22, 1900, S. 757–771.
- ↑ Otto-Albrecht Neumüller (Hrsg.): Römpps Chemie-Lexikon. Band 6: T–Z. 8. neubearbeitete und erweiterte Auflage. Franckh’sche Verlagshandlung, Stuttgart 1988, ISBN 3-440-04516-1, S. 4349.
- ↑ Hans-Dieter Jakubke, Hans Jeschkeit: Aminosäuren, Peptide, Proteine, Verlag Chemie, Weinheim 1982, ISBN 3-527-25892-2, S. 130–131.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 06.09. 2024