Oogenese
Oogenese (altgriechisch ᾠόν ō(i)ón „Ei“, γένεσις génesis „Entstehen, Werden“), auch Ovogenese,[1] von lat. ovum, das Ei, ist die Entwicklung einer befruchtungsfähigen Eizelle (Ovum) aus einer Zelle der Keimbahn bei mehrzelligen Tieren.[2]
Entwicklungsphasen
Bei sich sexuell fortpflanzenden Tieren ebenso beim Menschen beginnt die Entwicklung eines Individuums mit der Befruchtung einer Eizelle durch ein Spermium, die dabei zu einer diploiden Zygote wird. Davon ausgehend erfolgen nun fortlaufend mitotische Zellteilungen. Im Laufe vieler Zellgenerationen in den frühen Embryonalstadien entsteht eine Zelllinie diploider Keimbahnzellen, die als Urkeimzellen bezeichnet werden. Die Oogenese erfolgt in drei Perioden:
- Vermehrungsperiode mit mitotischen Teilungen der Urkeimzellen;
- Wachstumsperiode mit Einhüllung der Eizellen in ein Follikelepithel und Heranwachsen;
- Reifungsperiode mit zwei aufeinanderfolgenden meiotischen Teilungen.
Wachstum und Reifung finden in einem Ruhestadium statt.[3] Beim menschlichen weiblichen Embryo finden sich schon in der vierten Embryonalwoche in der Wand des Dottersacks weibliche Urkeimzellen, die ebenso wie die somatischen Zellen einen doppelten Chromosomensatz enthalten. Etwa um die sechste Embryonalwoche lagern sich diese in die Genitalleiste ein und werden zu Teilen der Keimepithelstränge. Aus den Keimepithelzellen entstehen durch Zellproliferation die Keimstränge als embryonale Anlagen der Ovarien. In der 17. bis 20. Schwangerschaftswoche der Mutter werden die als Oogonien bezeichneten „Ureizellen“ in den Ovarien des weiblichen Fötus zu primären Oozyten.[4]
Vermehrungsphase
Die Vermehrung der menschlichen Urkeimzellen beginnt in der 4. Schwangerschaftswoche. Die Oozyten im weiblichen Fötus vermehren sich bis zur 24. Schwangerschaftswoche durch Mitose auf bis zu 7 Millionen.[5] Viele Oozyten treten zeitnah in die erste Phase der meiotischen Reifeteilung ein. Anschließend verringert sich ihre Anzahl durch Apoptose, wobei Zellen verschwinden, die sich nicht zu fruchtbaren Eizellen entwickeln würden. Forschungsarbeiten an Caenorhabditis elegans deuten darauf hin, dass das Absterben eine Rolle für die Versorgung der überlebenden Oozyten mit Nährstoffen spielen könnte.[6] Die Zahlenangaben für die Oozyten in den Eierstöcken von neugeborenen Mädchen sind je nach Literaturquelle unterschiedlich. Nach einem Lehrbuch Gynäkologie und Geburtshilfe (A. Pfleiderer, M. Beckwoldt, G. Martius, 2001) befinden sich in jedem Eierstock bei der Geburt rund 400 000 Oozyten in Primordialfollikeln.[7]
Ruhestadium
Wachstumsphase
Die Wachstumsphase beträgt bei der Fruchtfliege Drosophila einige Tage, beim Menschen einige Monate (etwa 2. bis 7. Monat der weiblichen Embryonalentwicklung). Am Ende der Wachstumsphase wird das Oogonium als Oozyte erster Ordnung bezeichnet, deutsch „Eimutterzelle“. Die Oogonien lagern Dottersubstanzen ein, vergrößern sich und werden von Follikelzellen umgeben, wobei die Primordialfollikel entstehen. Anfangs bildet sich ein einschichtiger Zellverband um jede Oozyte, später wird die Hülle mehrschichtig und als Überlebende aus einer Kohorte von Primordialfollikeln entstehen die „Primärfollikel“.[8]
Reifungsphasen
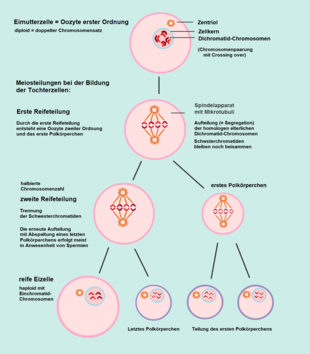
Erste meiotische Teilung
In den Primordialfollikeln beginnt im Anschluss an die letzte Oogonienteilung die Prophase der ersten Reifeteilung der Oozyte. Der doppelte Chromosomensatz wird dabei zu einem einfachen halbiert. Aus den Oozyten erster Ordnung (diploid) entstehen durch diese Reduktionsteilung Oozyten zweiter Ordnung (haploid). Während dieser ersten meiotischen Teilung gehen die Oozyten in den Primordialfollikeln in eine Ruhephase über (Diktyotän), die erst durch eine Aktivierung von außen beendet wird.[9]
Beim Menschen befinden sich im 10. bis 11. Monat nach seiner Zeugung die Oozyten in einem späten Abschnitt der Prophase der ersten Reifeteilung, dem Diplotän. Dieses Stadium kann als sogenanntes Diktyotän Jahrzehnte bestehen bleiben, bis es zur Ovulation der betreffenden Oozyte kommt.[10] Im Kindesalter bis zum Beginn der Pubertät sterben jedoch die meisten Oozyten ab. Die verbleibende Anzahl bei jungen Frauen sinkt auf etwa 200 000 Oozyten oder darunter,[11] von denen letztlich nur sehr wenige zur befruchtungsfähigen Eizelle heranreifen. Bedingt durch den Monatszyklus erreichen pro Jahr im Mittelwert 12 Eizellen den Eisprung, das wären bspw. in 40 fruchtbaren Jahren einer Frau (vom 12. bis zum 52. Lebensjahr) 480 Eizellen.
Zweite meiotische Teilung
Bei der Oocyte zweiter Ordnung (haploid) erfolgt nun die zweite Reifeteilung. Diese entspricht prinzipiell einer Mitose, da die nun aus zwei Chromatiden bestehenden Dichromatidchromosomen getrennt werden und als Monochromatidchromosomen in die Tochterzellen gelangen.[12] Da der vollständige einfache Chromosomensatz dabei erhalten bleibt, nennt man sie auch „Äquationsteilung“.
Beim Menschen beginnen in jedem Menstruationszyklus nur wenige Oozyten zweiter Ordnung hormongesteuert die zweite Reifeteilung. Hiervon erreicht meist nur eine Oozyte das Stadium einer reifen Eizelle, die restlichen degenerieren. In der Metaphase der zweiten Reifeteilung wird die Entwicklung der Eizelle arretiert.[13] Wenn die Eizelle beim Eisprung den Eierstock verlässt, befindet sie sich in der Metaphase II der zweiten Reifeteilung. Im Falle einer Befruchtung durch ein Spermium erfolgen die weiteren Stadien der zweiten Reifeteilung während der Entwicklung der Zygote.
Bei der Meiose findet bei beiden Reifeteilungen jeweils eine ungleiche (inäquale) Zellteilung statt: Die Tochterzellen bestehen jeweils aus einer groß bleibenden Oozyte und einer kleinen Zelle, die abgegliedert wird. Die ersten abgegliederten Zellen werden entweder aufgelöst (resorbiert) oder sie durchlaufen ebenfalls eine zweite Reifeteilung. Die abgegliederten Zellen werden als Polkörperchen (oder Richtungskörperchen) bezeichnet und sind beim Menschen funktionslos. Somit entstehen – anders als bei der Spermatogenese – aus einer weiblichen Urkeimzelle nicht vier gleiche Gameten, sondern nur eine sehr plasmareiche Eizelle.[14]
Postnatale Oogenese
In der Kindheit nimmt die Zahl der Oozyten in den Eierstöcken weiter stark ab. Bei erwachsenen Frauen sinkt sie auf unter 200 000.[15] In einer Studie (2015) bei der von rund 1 Million Follikel bei neugeborenen Mädchen ausgegangen wurde, fanden sich in den Ovarien von 95 % der 30-jährigen Frauen noch 12 % der nicht wachsenden Follikelpopulationen, bei 40-jähren Frauen nur noch 3 %. Die Anzahl der nicht wachsenden Follikel stieg aber von der Geburt bis etwa zum 14. Lebensjahr an und nahm danach bis zur Menopause stark ab. In den Eierstöcken erwachsener Frauen gibt es verschiedene Populationen von Stammzellen. Die Forschungsergebnisse legen nahe, dass eine postnatale (Fortsetzung der) Oogenese nicht ausgeschlossen werden kann. Ziel der Forschungen, um Stammzellen in den Ovarien und Eizellen besser zu verstehen, ist, einen Ansatz für die Behandlung der Eierstockunfruchtbarkeit bei jungen Frauen mit Kinderwunsch zu finden.[16][17]
Segregation der Chromosomen
Die primären Oozyten im weiblichen menschlichen Embryo enthalten Chromosomen von der Mutter und vom Vater zu gleichen Anteilen, also jeweils 23. Während der ersten Reifeteilung erfolgt eine Verteilung der jeweils von Mutter und Vater stammenden homologen Chromosomen auf die Tochterzellen, von denen eine zum ersten Polkörperchen wird. Infolgedessen befindet sich in der Oozyte zweiter Ordnung nur noch die Hälfte des zuvor vorhandenen genetischen Materials und zwar als individuelle Kombination. Der Anteil an mütterlichen und väterlichen Erbanlagen kann nun unterschiedlich sein.
Bei der zweiten Reifeteilung werden die Dichromatid-Chromosomen getrennt und als Monochromatid-Chromosomen auf die beiden Tochterzellen verteilt. Hierbei gelangt die gleiche genetische Information in den Zellkern der Eizelle wie in den Zellkern des letzten Polkörperchens. In manchen Oozyten trennen sich nicht alle Paare homologer Chromosomen, in so einem Fall gelangen beide in dieselbe Tochterzelle. Auch bei der Auftrennung der Dichromatid-Chromosomen kann selten eines zusammenbleiben, so dass sie nicht als Monochromatid-Chromosomen auf die Tochterzellen verteilt werden (Non-Disjunction). Daraus ergibt sich in einer der Tochterzellen ein doppeltes Vorliegen des betreffenden Chromosoms, während es in der anderen fehlt. Bei doppeltem Vorliegen eines Chromosoms entsteht nach der Befruchtung der Eizelle mit einem normalen Spermium eine Trisomie, beim Fehlen eine Monosomie.[18] Solche Aneuploidien treten bei menschlichen Embryonen am häufigsten beim 22., 16., 21. und 15. Chromosom auf, selten beim 14. und 6. Chromosom, und bei den Geschlechtschromosomen (X-Chromosom und Y-Chromosom).[19][20] Auch bei der Bildung der Spermien können solche Unregelmäßigkeiten bei der Segregation der Chromosomen auftreten, die zu einer Genommutation führen.
Einzelnachweise
- ↑ In der Literatur findet man neben vielen zusammengesetzten Fachbegriffen wie Oocyte, Oogonium oder Oolemma auch die lateinisch-griechische Mischform wie Ovozyte, Ovogonium und Ovolemma.
- ↑ NCBI:
 Oogenesis
Oogenesis
- ↑ Hans E. Stegner:
 Die Feinstrukturen der Eizelle während der Oogenese. In: Die elektronenmikroskopische Struktur der Eizelle.
Ergebnisse der Anatomie und Entwicklungsgeschichte / Reviews of Anatomy, Embryology and Cell Biology / Revues d’anatomie et de morphologie expérimentale, Band 39, Ausgabe 6. Springer,
Berlin / Heidelberg, 1967.
Die Feinstrukturen der Eizelle während der Oogenese. In: Die elektronenmikroskopische Struktur der Eizelle.
Ergebnisse der Anatomie und Entwicklungsgeschichte / Reviews of Anatomy, Embryology and Cell Biology / Revues d’anatomie et de morphologie expérimentale, Band 39, Ausgabe 6. Springer,
Berlin / Heidelberg, 1967.
- ↑ Albrecht Pfleiderer, Meinert Breckwoldt, Gerhard Martius: Gynäkologie und Geburtshilfe. 4. Auflage. Thieme Verlag 2001, S. 1.
- ↑ Albrecht Pfleiderer, Meinert Breckwoldt, Gerhard Martius: Gynäkologie und Geburtshilfe. 4. Auflage. Thieme Verlag 2001, S. 1.
- ↑ M. Buszczak, L. Cooley:
 Eggs to die for: cell death during Drosophila oogenesis. In: Nature, Cell Death & Differeciation. Band 7. S. 1071–1074,
9. November 2000.
Eggs to die for: cell death during Drosophila oogenesis. In: Nature, Cell Death & Differeciation. Band 7. S. 1071–1074,
9. November 2000.
- ↑ Albrecht Pfleiderer, Meinert Breckwoldt, Gerhard Martius: Gynäkologie und Geburtshilfe. 4. Auflage. Thieme Verlag 2001, S. 20.
- ↑ Neil A. Campbell, Jane B. Reece: Biologie. Heidelberg/ Berlin 2003, S. 1181–1182.
- ↑ Hans E. Stegner:
 Die Feinstrukturen der Eizelle während der Oogenese. In: Die elektronenmikroskopische Struktur der Eizelle.
Ergebnisse der Anatomie und Entwicklungsgeschichte / Reviews of Anatomy, Embryology and Cell Biology / Revues d’anatomie et de morphologie expérimentale, Band 39, Ausgabe 6. Springer,
Berlin / Heidelberg, 1967.
Die Feinstrukturen der Eizelle während der Oogenese. In: Die elektronenmikroskopische Struktur der Eizelle.
Ergebnisse der Anatomie und Entwicklungsgeschichte / Reviews of Anatomy, Embryology and Cell Biology / Revues d’anatomie et de morphologie expérimentale, Band 39, Ausgabe 6. Springer,
Berlin / Heidelberg, 1967.
- ↑ Debora Dankert:
 Auswirkung einer postovulatorischen Alterung auf molekulare
Parameter und die Entwicklungskompetenz muriner Oozyten Seite 8 – 10
Auswirkung einer postovulatorischen Alterung auf molekulare
Parameter und die Entwicklungskompetenz muriner Oozyten Seite 8 – 10
- ↑ Albrecht Pfleiderer, Meinert Breckwoldt, Gerhard Martius: Gynäkologie und Geburtshilfe. 4. Auflage. Thieme Verlag 2001, S. 1.
- ↑ Werner Buselmaier:
 Meiose (Keimzellbildung). In: Biologie für Mediziner. Springer Medizin Verlag, Heidelberg, 2009.
Meiose (Keimzellbildung). In: Biologie für Mediziner. Springer Medizin Verlag, Heidelberg, 2009.
- ↑ Neil A. Campbell, Jane B. Reece: Biologie. Heidelberg/ Berlin 2003, S. 1182.
- ↑ Neil A. Campbell, Jane B. Reece: Biologie. Heidelberg/ Berlin 2003, S. 1182.
- ↑ Albrecht Pfleiderer, Meinert Breckwoldt, Gerhard Martius: Gynäkologie und Geburtshilfe. 4. Auflage. Thieme Verlag 2001, S. 1.
- ↑ Irma Virant-Klun:
 Postnatal oogenesis in humans: a review of
recent findings. In: Dovepress, Band 8, 20 March 2015, S. 49–60.
Postnatal oogenesis in humans: a review of
recent findings. In: Dovepress, Band 8, 20 March 2015, S. 49–60.
- ↑ Irma Virant-Klun (Hrsg.), Aleksandar Nikolic, Vladislav Volarevic et al.:
 Primordial Germ Cells: Current Knowledge and Perspectives. In: Stem Cells International. 9. November 2015.
Primordial Germ Cells: Current Knowledge and Perspectives. In: Stem Cells International. 9. November 2015.
- ↑ Neil A. Campbell, Jane B. Reece: Biologie. Heidelberg/ Berlin 2003, S. 330–333.
- ↑ J. D. A. Delhanty:
 Mechanisms of aneuploidy induction in human oogenesis and early embryogenesis. In: Cytogenetic Genome Research,
Band 111, S. 237–244, 2005.
Mechanisms of aneuploidy induction in human oogenesis and early embryogenesis. In: Cytogenetic Genome Research,
Band 111, S. 237–244, 2005.
- ↑ Terry Hassold, Heather Maylor-Hagen et al.:
 Failure to recombine is a common feature of human oogenesis. In: AJHG, Band 108, Ausgabe 1, 7.
Januar 2021, S. 16–24.
Failure to recombine is a common feature of human oogenesis. In: AJHG, Band 108, Ausgabe 1, 7.
Januar 2021, S. 16–24.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 13.12. 2025